【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (58 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第Ⅱb 相パート<2022 年 1 月~3 月>
SARS-CoV-2 による感染症患者[目標例数 435 例(各群 145 例)55)]を対象に、本薬の有効性及び安
全性を検討することを目的として、プラセボ対照無作為化二重盲検並行群間比較試験が、日本及び韓国
の 2 カ国 88 施設で実施された。本試験の主な選択・除外基準は表 34 のとおりであった。
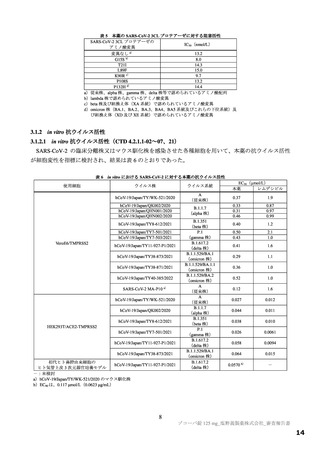
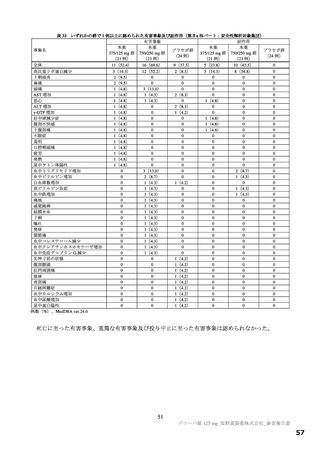
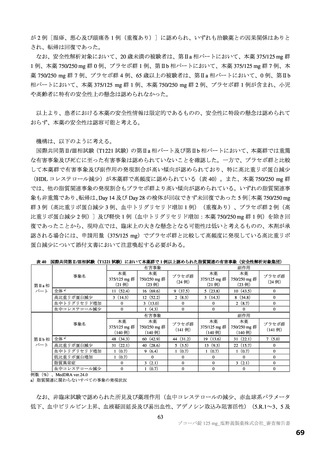
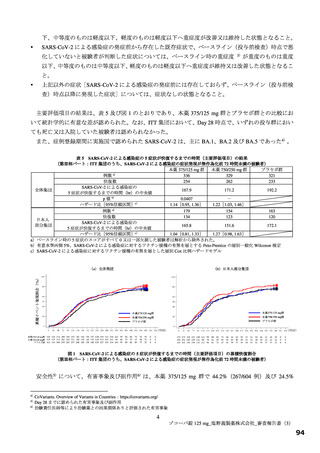
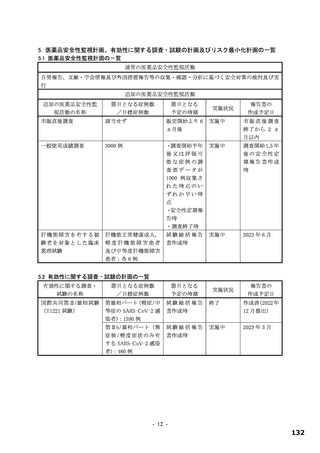
表 34 主な選択・除外基準
12 歳以上 20 歳未満かつ体重 40 kg 以上又は 20 歳以上 70 歳未満
SARS-CoV-2 陽性(無作為化前 120 時間以内に採取された検体を用いた PCR 検査等により確認)
SARS-CoV-2 による感染症の症状(14 症状 a)のうち 1 つ以上)発現が無作為化前 120 時間以内
無作為化時点において、SARS-CoV-2 による感染症の症状(12 症状)b)のうち、中等度(スコア 2)c)以上の症状
選択基準
が 1 つ以上認められる。ただし、SARS-CoV-2 による感染症の発症前から存在した症状である場合は、SARS-CoV2 による感染症により悪化したと被験者が判断した症状に限る
5.
治験薬投与開始~投与終了後少なくとも 10 日間避妊が可能な者
6.
(女性のみ)妊婦ではなく、妊娠している可能性もない者
1.
SpO2 が 93%以下(室内気)
2.
酸素投与を要する
除外基準
3.
人工呼吸器を要する
4.
中等度以上(CTCAE 第 5.0 版 Grade 2 以上)の肝疾患の現病歴又は慢性病歴を有する
5.
中等度以上(CTCAE 第 5.0 版 Grade 2 以上)の腎疾患の現病歴又は慢性病歴を有する
a)①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発汗、⑤熱っぽさ又は発熱、⑥鼻水又は鼻づまり、⑦喉の痛み、
⑧咳、⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢、⑬味覚異常、⑭嗅覚異常
b)①倦怠感(疲労感)、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発汗、⑤熱っぽさ又は発熱、⑥鼻水又は鼻づまり、⑦喉の痛み、
⑧咳、⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢
c)症状のスコアを被験者本人が 4 段階(0:なし、1:軽度、2:中等度、3:重度)で評価
1.
2.
3.
4.
用法・用量は、①1 日目は本薬 375 mg を 1 日 1 回、2 日目から 5 日目は本薬 125 mg を 1 日 1 回経口
投与(以下、「本薬 375/125 mg 群」)、②1 日目は本薬 750 mg を 1 日 1 回、2 日目から 5 日目は本薬
250 mg を 1 日 1 回経口投与(以下、「本薬 750/250 mg 群」)、又は③プラセボを 1 日 1 回 5 日間経口
投与することとされた。
無作為化された 428 例(本薬 375/125 mg 群 142 例、本薬 750/250 mg 群 143 例、プラセボ群 143 例)
のうち、治験薬が 1 回以上投与された 421 例(本薬 375/125 mg 群 140 例、本薬 750/250 mg 群 140 例、
プラセボ群 141 例)が安全性解析対象集団とされた。無作為化された 428 例のうち、ベースラインの鼻
咽頭ぬぐい検体 51)において SARS-CoV-2 のウイルス力価が検出された 341 例(本薬 375/125 mg 群 114
例、本薬 750/250 mg 群 116 例、プラセボ群 111 例)が ITT1 集団とされ、ITT1 集団が有効性の解析対象
集団とされた。
試験中止例は 19 例(本薬 375/125 mg 群 8 例、本薬 750/250 mg 群 7 例、プラセボ群 4 例)であり、中
止理由の内訳は、被験者の申し出 11 例(本薬 375/125 mg 群 4 例、本薬 750/250 mg 群 4 例、プラセボ群
3 例)、追跡不能 4 例(本薬 375/125 mg 群 2 例、本薬 750/250 mg 群 1 例、プラセボ群 1 例)、有害事象
1 例(本薬 375/125 mg 群)、SARS-CoV-2 陰性が判明 1 例(本薬 750/250 mg 群)、疾患進行 1 例(本薬
750/250 mg 群)、その他56)1 例(本薬 375/125 mg 群)であった。
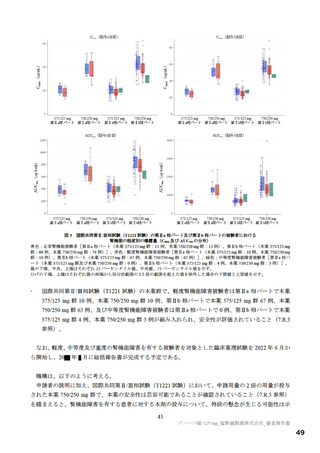
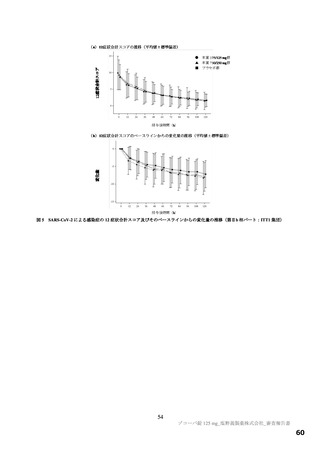
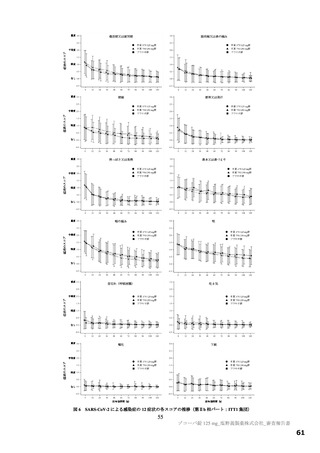
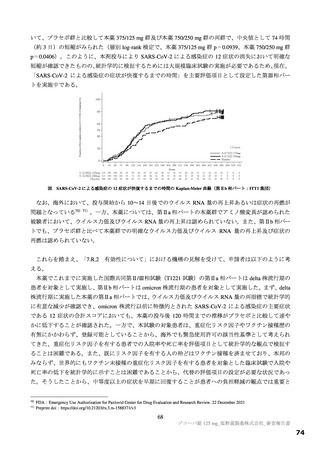
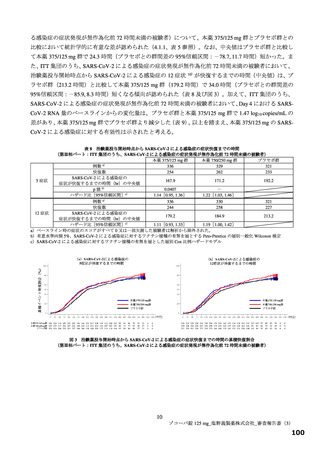
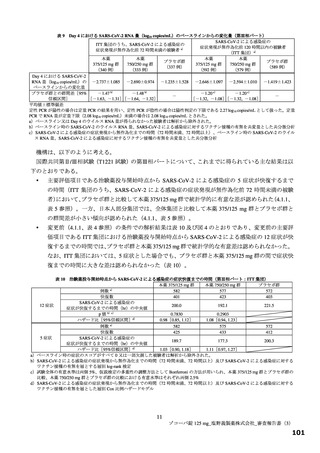
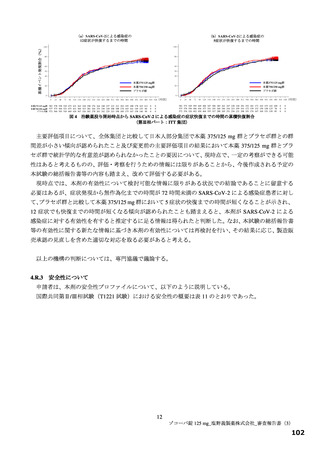
主要評価項目の SARS-CoV-2 による感染症の 12 症状合計スコアの治験薬投与開始(Day 1)から 120 時間(Day 6)までの単位時間当
たりの変化量について、各本薬群とプラセボ群の間の期待群間差を-1、各投与群の想定される標準偏差を 2.6 と仮定し、有意水準片
側 2.5%の下、検出力 80%とするために必要な例数として 1 群 108 例と算出され、ウイルス力価未検出による脱落を 25%と想定し、目
標例数は 435 例(各群 145 例)とされた。なお、もう 1 つの主要評価項目である Day 4 における SARS-CoV-2 のウイルス力価のベー
スラインからの変化量について、各本薬群とプラセボ群の間の期待群間差を-0.5 log10 TCID50/mL、各投与群の想定される標準偏差を
0.7 と仮定し、有意水準片側 2.5%、例数を 435 例(各群 145 例)としたとき、各本薬群とプラセボ群の各比較における検出力は 99.9%
となる。
56)
合併症の治療を優先するため。
55)
52
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
58