【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
死量は、ラットで 2,000 mg/kg 超、サルで 1,000 mg/kg 超と判断された。主な急性症状として、雄性サル
への 1,000 mg/kg 投与で嘔吐が認められた。サルにおいて PDE4 阻害剤による嘔吐作用が報告されてい
ること(Toxicol Pathol 2004; 32: 295-308)及び副次的薬理試験(3.2.1 参照)において本薬による PDE 阻
害が認められていることから、申請者は、嘔吐の発生機序について本薬の PDE4 阻害が関与する可能性
があると説明している。
5.2
反復投与毒性試験
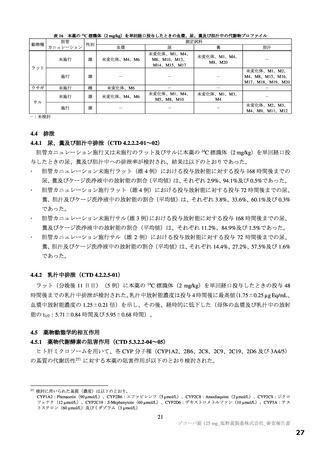
ラットを用いた 2 週間及び 4 週間の反復投与毒性試験が実施された(表 17)。主な異常所見として血
中直接及び間接ビリルビン濃度の低値が認められたが、関連する病理組織学的変化が認められなかった
ことから、申請者は毒性とは判断していない。その他の溶媒群と比較して有意な変動が認められた検査
値は、関連する病理組織学的変化が認められない又は試験施設の背景値内であったことから、申請者は
毒性学的意義は低いと判断している。ラットを用いた 4 週間の反復投与毒性試験における無毒性量は
1,000 mg/kg/日と判断され、このときの本薬の血漿中曝露量(AUC0-24 h 、雄:4,270 μg・h/mL、雌:
5,380 μg・ h/mL)は、ヒトにおける本剤投与時の本薬の血漿中曝露量35)(AUCtau:518.3 μg・h/mL)と比
較して、雄で約 8.2 倍、雌で約 10 倍であった。
試験系
投与
経路
投与
期間
雌雄
ラット
(SD)
強制
経口
2 週間
(1 回/日)
+回復 2 週間
強制
経口
4 週間
(1 回/日)
+回復 4 週間
雌雄
ラット
(SD)
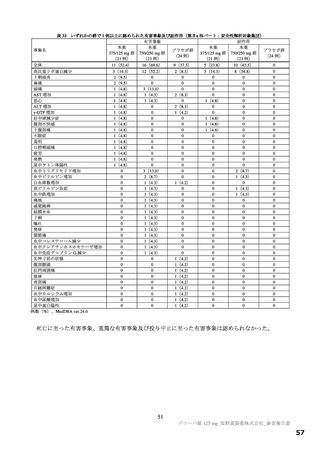
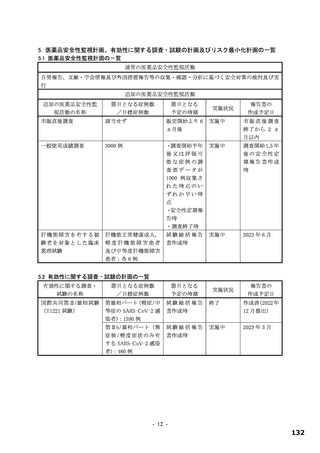
表 17 ラットを用いた反復投与毒性試験成績の概略
用量
無毒性量
添付資料
主な所見
CTD
(mg/kg/日)
(mg/kg/日)
1,000:摂餌量低値、血中総ビリルビン低値(雌雄)、血中直
接ビリルビン低値、体重・体重増加量低値、血中グルコース
0、20、
1,000
4.2.3.2-01
低値(雄)
100、1,000
0、20、
50、1,000
回復期間:なし
1,000:血中直接・間接ビリルビン低値(雌雄)、リンパ球数
高値(雄)
1,000
4.2.3.2-02
回復期間:なし
サルを用いた 2 週間及び 4 週間の反復投与毒性試験が実施された(表 18)。主な毒性又は異常所見と
して、脱水、無摂餌、摂餌量減少又は体重低下等が認められた後に一般状態悪化に起因する死亡、血中
直接・総ビリルビン濃度上昇、血中コレステロール減少、赤血球系パラメータ及び血小板数低値、スト
レスに伴う二次的な変化として血中リンパ球数及び免疫系組織のリンパ球密度減少等の免疫抑制を示唆
する所見、血液凝固系異常、全身の器官・組織における出血性変化、低カルシウム・低カリウム血症に
伴う QT/QTc 間隔延長が認められた。また、死亡例のみに、一般状態の悪化によるストレスに起因した
リンパ球系パラメータの低下(Toxicol Pathol 2013; 41: 560-614)に伴う免疫抑制に関連すると考えられる
日和見感染(Toxicol Pathol 2021; 49: 397-407、J Immunotoxicol 2010; 7: 128-37)、感染に伴う炎症反応と
関連する二次的変化、並びに骨髄造血細胞減少が認められた。生存例では、細菌感染による炎症反応と
関連しない脾臓とリンパ節における組織球及び形質細胞の増加、並びにその他複数の器官・組織におけ
る単核細胞主体の炎症性細胞浸潤、血中炎症性マーカーの変動及び炎症性変化に関連する二次的な変化
が認められた。溶媒群と比較して有意な変動が認められた尿検査値及び血中電解質の低下、血中 CD3+
CD8+細胞・CD3+CD4+比率低下、血中 ALP 及び LDH 活性上昇、脾臓重量高値、肝細胞肥大、心臓・皮
第Ⅰ相試験(T1211 試験)において、健康成人女性に 1 日目は本薬 375 mg を 1 日 1 回、2 日目から 5 日目は本薬 125 mg を 1 日 1 回
経口投与したときの投与 5 日目の血漿中曝露量(6.2.1.2 参照)。
35)
24
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
30