【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (74 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
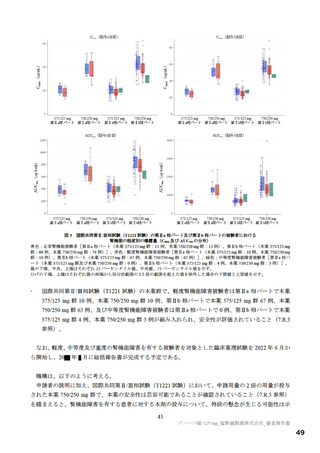
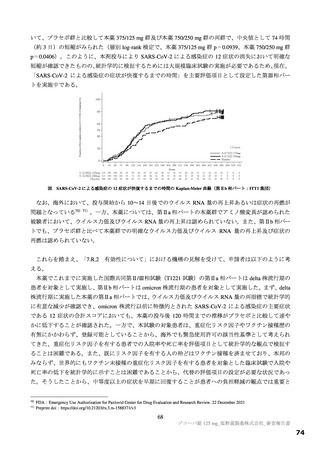
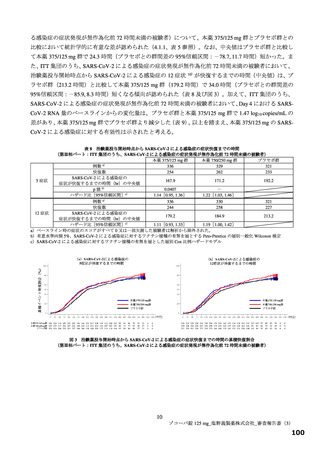
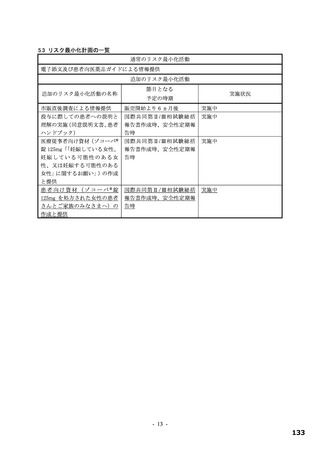
(約 3 日)の短縮がみられた(層別 log-rank 検定で、本薬 375/125 mg 群 p=0.0939、本薬 750/250 mg 群
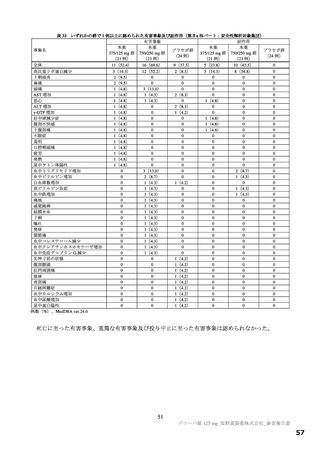
p=0.0406)。このように、本剤投与により SARS-CoV-2 による感染症の 12 症状の消失において明確な
短縮が確認できたものの、統計学的に検証するためには大規模臨床試験の実施が必要であるため、現在、
「SARS-CoV-2 による感染症の症状が快復するまでの時間」を主要評価項目として設定した第Ⅲ相パー
トを実施中である。
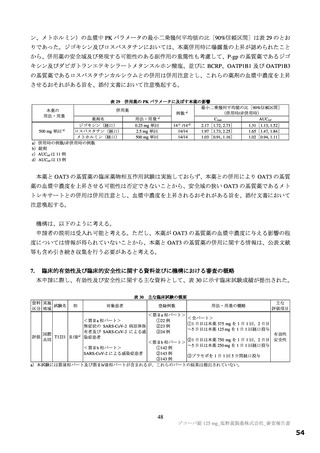
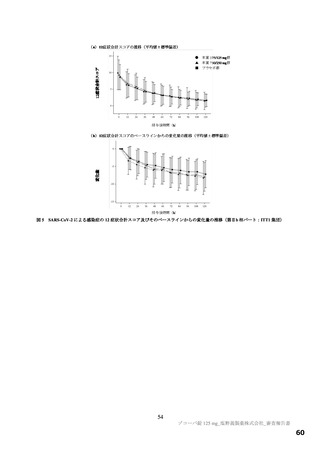
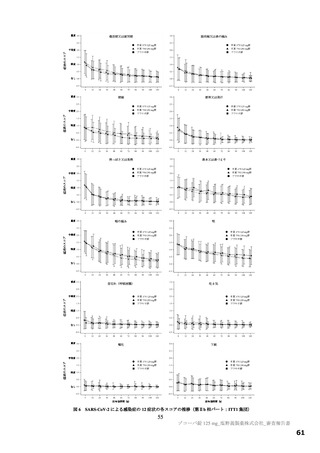
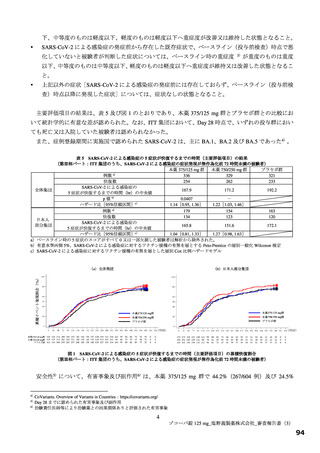
図
SARS-CoV-2 による感染症の 12 症状が快復するまでの時間の Kaplan-Meier 曲線(第Ⅱb 相パート:ITT1 集団)
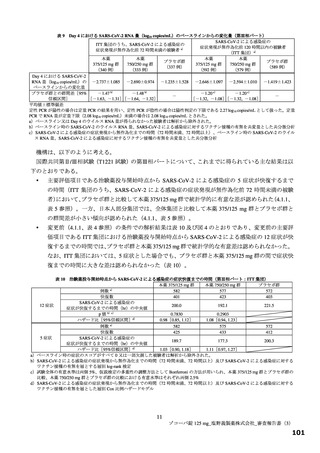
なお、海外において、投与開始から 10~14 日後でのウイルス RNA 量の再上昇あるいは症状の再燃が
問題となっている70)71)。一方、本薬については、第Ⅱa 相パートの本薬群でアミノ酸変異が認められた
被験者において、ウイルス力価及びウイルス RNA 量の再上昇は認められていない。また、第Ⅱb 相パー
トでも、プラセボ群と比べて本薬群での明確なウイルス力価及びウイルス RNA 量の再上昇及び症状の
再燃は認められていない。
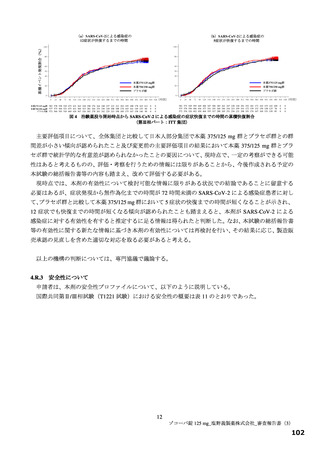
これらを踏まえ、「7.R.2 有効性について」における機構の見解を受けて、申請者は以下のように考
える。
本薬でこれまでに実施した国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相パートは delta 株流行期の
患者を対象として実施し、第Ⅱb 相パートは omicron 株流行期の患者を対象として実施した。まず、delta
株流行期に実施した本薬の第Ⅱa 相パートでは、ウイルス力価及びウイルス RNA 量の両指標で統計学的
に有意な減少が確認でき、omicron 株流行以前に特徴的とされた SARS-CoV-2 による感染症の主要症状
である 12 症状の合計スコアにおいても、本薬の投与後 120 時間までの推移がプラセボと比較して速や
かに低下することが確認された。一方で、本試験の対象患者は、重症化リスク因子やワクチン接種歴の
有無にかかわらず、登録可能としていることから、海外でも緊急使用許可の該当性基準として考えられ
てきた、重症化リスク因子を有する患者での入院率や死亡率を評価項目として統計学的な観点で検証す
ることは困難である。また、既にリスク因子を有する人の殆どはワクチン接種を済ませており、本邦の
みならず、世界的にもワクチン未接種の重症化リスク因子を有する患者を対象とした臨床試験で入院や
死亡率の低下を統計学的に示すことは困難であることから、代替の評価項目の設定が必要な状況であっ
た。そうしたことから、中等度以上の症状を早期に回復することが患者への負担軽減の観点では重要と
70)
71)
FDA:Emergency Use Authorization for Paxlovid Center for Drug Evaluation and Research Review. 22 December 2021
Preprint doi:https://doi.org/10.21203/rs.3.rs-1588371/v3
68
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
74