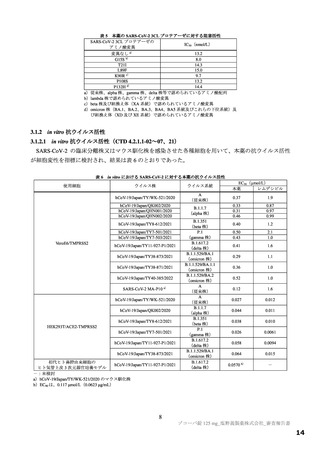
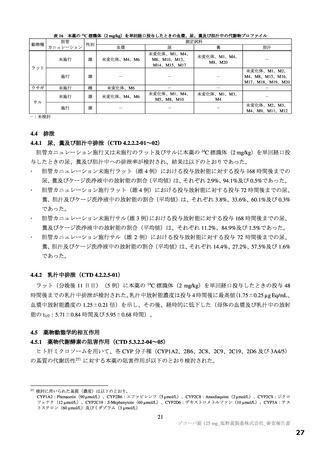
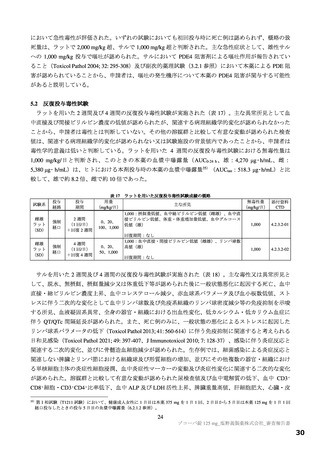
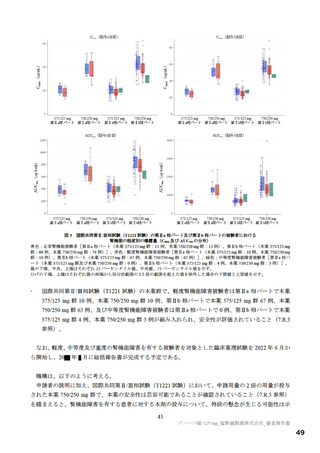
【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (108 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和 4 年 11 月 15 日
申請品目
[販 売 名]
ゾコーバ錠 125 mg
[一 般 名]
エンシトレルビル フマル酸
[申 請 者]
塩野義製薬株式会社
[申請年月日]
令和 4 年 2 月 25 日
[略語等一覧]
別記のとおり。
1.
審査内容
専門協議及びその後の機構における審査の概略は、以下のとおりである。なお、本専門協議の専門委員
は、本品目についての専門委員からの申し出等に基づき、「医薬品医療機器総合機構における専門協議等
の実施に関する達」(平成 20 年 12 月 25 日付け 20 達第 8 号)の規定により、指名した。
専門協議において、審査報告(3)に記載した「4.R.2
有効性について」、「4.R.3
安全性について」
及び「4.R.5 用法・用量について」に関する機構の判断は専門委員から支持された。
1.1 臨床的位置付けについて
専門協議において、審査報告(3)に記載した「4.R.4 臨床的位置付け及び効能・効果について」に関
する機構の判断は専門委員から支持され、追加で以下の意見が出された。
添付文書における投与開始時期に関する記載は、安全性の懸念によるものではなく、症状発現(0 日
目)から 3 日目までに投与開始された患者において有効性が推定された旨の注意喚起であることを
明確にすることが肝要である。
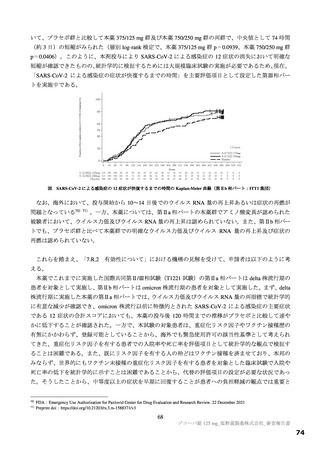
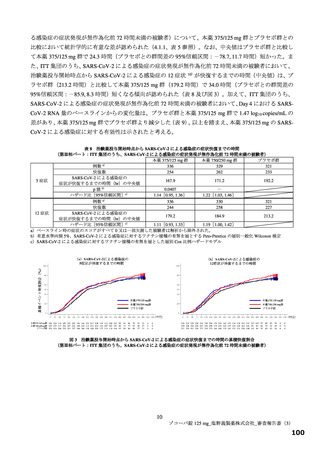
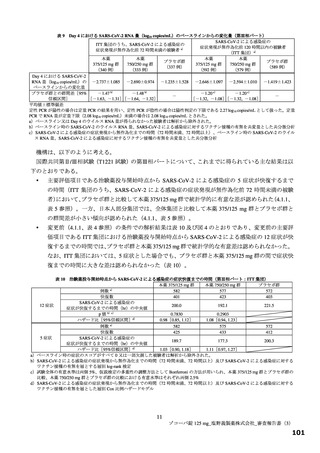
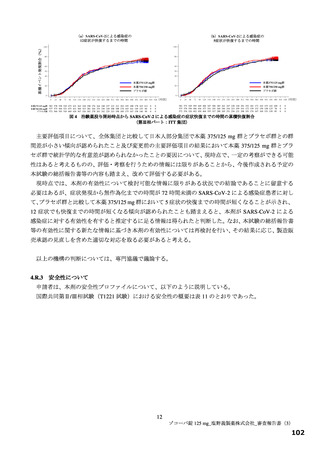
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅲ相パートの対象患者(重症化リスク因子の有無によらな
い軽症~中等症Ⅰ相当の患者)等を踏まえると、本剤は SARS-CoV-2 による感染症患者に広く使用さ
れる可能性がある。現時点で本薬に対する耐性化や重篤な有害事象に係る具体的な懸念はないもの
の、広く使用された場合に、これらの懸念が顕在化する可能性は否定できない。また、国際共同第Ⅱ
/Ⅲ相試験(T1221 試験)の第Ⅲ相パートにおける主要評価項目や得られた成績を医師が十分に理解
した上で、本剤の使用の必要性を慎重に検討するよう注意喚起するべきである。
本剤の使用実態下における重症化(死亡や入院)の有無についても、使用成績調査において情報収集
することは重要である。
機構は、以上の専門協議における議論を踏まえ、添付文書に以下の注意喚起を追記すること、また使用
成績調査において重症化に関する情報を収集することを申請者に指示し、申請者は了解した。
18
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書(3)
108