【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (93 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(以下、「本薬 750/250 mg 群」)、又はプラセボを 1 日 1 回 5 日間経口投与することとされた。
第Ⅲ相パートは、第Ⅱb 相パートの症例登録完了後に開始することとされ、2022 年 2 月 10 日より開始
し、2022 年 8 月 8 日にすべての被験者の観察期間[追跡期:治験薬投与開始日(Day 1)~Day 28]が完
了した。2022 年 9 月 20 日に改訂[開鍵(2022 月 9 月 23 日)前の最終改訂]されたプロトコル第 10 版に
おいて、有効性の検証対象の用量、主要評価項目、有効性の主要な解析対象集団、必要被験者数及び主要
解析の方法等(表 4)が変更された後、第Ⅲ相パートの解析が実施された。
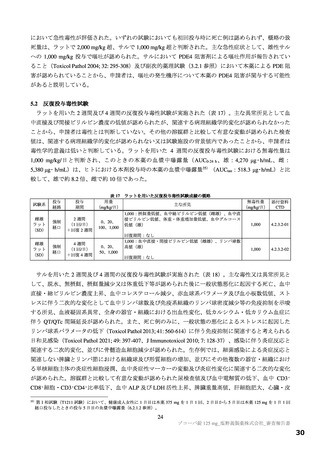
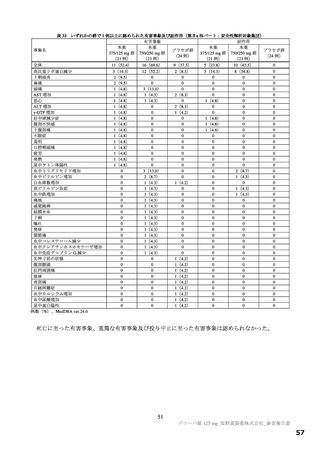
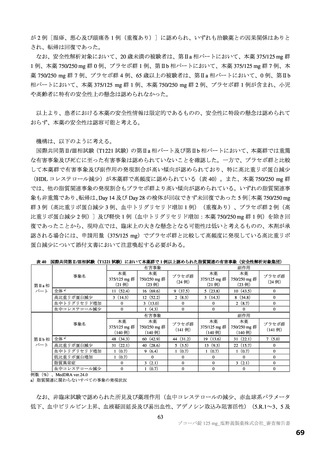
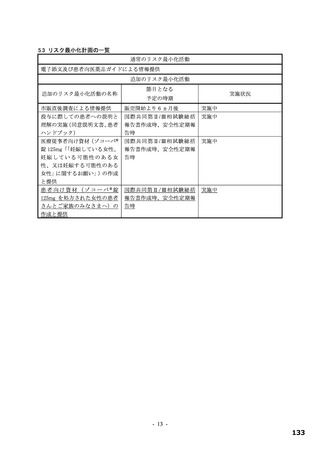
表 4 プロトコルの主な変更点[下線部:各版で異なる箇所。試験中の主な試験計画の変更内容は 6.1 参照]
変更前
変更後
第 9 版(2022 年 7 月 8 日改訂)
第 10 版(2022 年 9 月 20 日改訂)
有効性の
・本薬 375/125 mg
・本薬 375/125 mg
検証対象の用量
・本薬 750/250 mg
治験薬投与開始時点から SARS-CoV-2 による感染症の 治験薬投与開始時点から SARS-CoV-2 による感染症の
12 症状が快復するまでの時間
5 症状が快復するまでの時間
主要評価項目
有効性の
主要な解析対象集団
必要被験者数
主要解析の方法
<12 症状>
<5 症状>
①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、 ①倦怠感又は疲労感、②熱っぽさ又は発熱、③鼻水又
④悪寒又は発汗、⑤熱っぽさ又は発熱、⑥鼻水又は鼻 は鼻づまり、④喉の痛み、⑤咳
づまり、⑦喉の痛み、⑧咳、⑨息切れ(呼吸困難)、
⑩吐き気、⑪嘔吐、⑫下痢
ITT 集団のうち、SARS-CoV-2 による感染症の症状発現
ITT 集団
が無作為化前 72 時間未満の被験者
1,590 例(各群 530 例)
780 例(各群 260 例)
層別 log-rank 検定
Peto-Prentice の層別一般化 Wilcoxon 検定
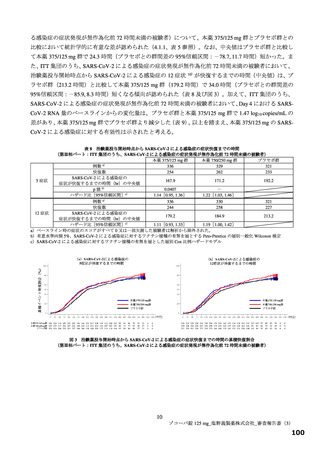
無作為化された 1,821 例(本薬 375/125 mg 群 607 例、本薬 750/250 mg 群 606 例及びプラセボ群 608 例)
のうち、治験薬が 1 回以上投与された 1,808 例(本薬 375/125 mg 群 604 例、本薬 750/250 mg 群 599 例及
びプラセボ群 605 例)が安全性解析対象集団とされた。無作為化された 1,821 例のうち、ベースラインの
鼻咽頭ぬぐい検体2)を用いた RT-PCR 検査結果が SARS-CoV-2 陽性であった 1,798 例(本薬 375/125 mg 群
603 例、本薬 750/250 mg 群 595 例及びプラセボ群 600 例)が ITT 集団とされ、ITT 集団のうち、SARSCoV-2 による感染症の症状発現が無作為化前 72 時間未満であった 1,030 例(本薬 375/125 mg 群 347 例、
本薬 750/250 mg 群 340 例及びプラセボ群 343 例)が有効性の主要な解析対象集団とされた。
試験中止例は 52 例(本薬 375/125 mg 群 11 例、本薬 750/250 mg 群 21 例及びプラセボ群 20 例)であり、
中止理由の内訳は、被験者の申し出 24 例(本薬 375/125 mg 群 3 例、本薬 750/250 mg 群 11 例及びプラセ
ボ群 10 例)、プロトコル違反 5 例(本薬 375/125 mg 群 3 例、本薬 750/250 mg 群 1 例及びプラセボ群 1
例)、有害事象 4 例(本薬 750/250 mg 群 2 例及びプラセボ群 2 例)、疾患進行 1 例(プラセボ群)、そ
の他 18 例(本薬 375/125 mg 群 5 例、本薬 750/250 mg 群 7 例及びプラセボ群 6 例)であった。
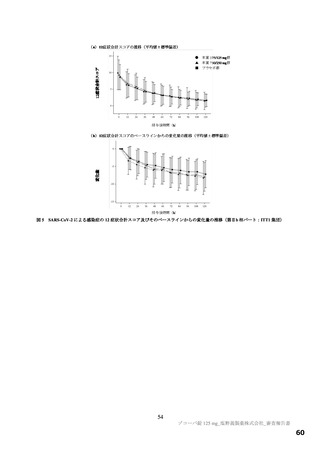
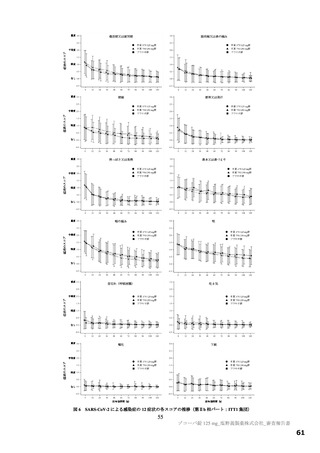
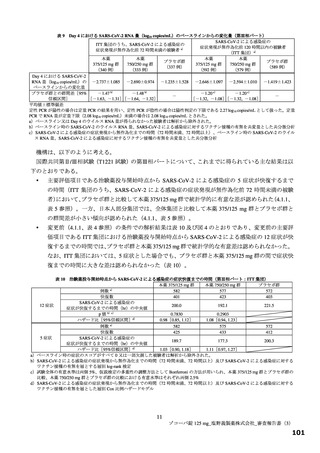
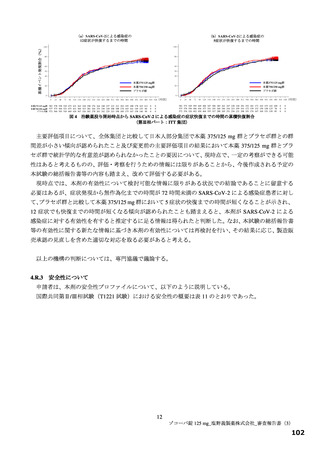
有効性について、主要評価項目は、治験薬投与開始時点から SARS-CoV-2 による感染症の 5 症状が快復
するまでの時間とされ、快復の定義は、5 症状のすべてが以下の状態を少なくとも 24 時間持続した場合
とされた。
SARS-CoV-2 による感染症の発症前から存在した既存症状で、ベースライン(投与前検査)時点で悪
化していると被験者が判断した症状については、ベースライン時の重症度3)が重度のものは中等度以
治験薬投与開始日又はその前日の検体
重症度は、各症状のスコアを被験者本人が 4 段階(0:なし、1:軽度、2:中等度、3:重度)で評価することとされた。
2)
3)
3
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書(3)
93