【資料2】新型コロナウイルス感染症治療薬(ゾコーバ錠125mg)について(医薬・生活衛生局からの説明資料) (83 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
機構による承認申請書に添付すべき資料に係る適合性調査結果及び機構の判断
3.1
適合性書面調査結果に対する機構の判断
現在、調査実施中であり、その結果及び機構の判断は別途報告する。
3.2
GCP 実地調査結果に対する機構の判断
現在、調査実施中であり、その結果及び機構の判断は別途報告する。
4.
総合評価
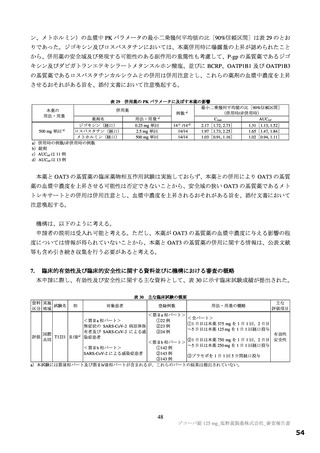
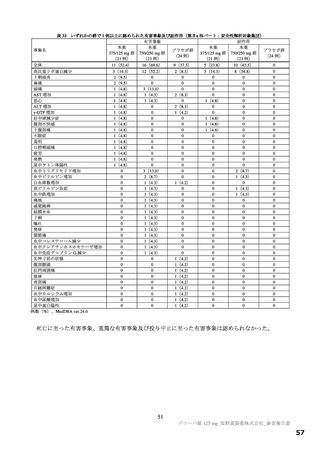
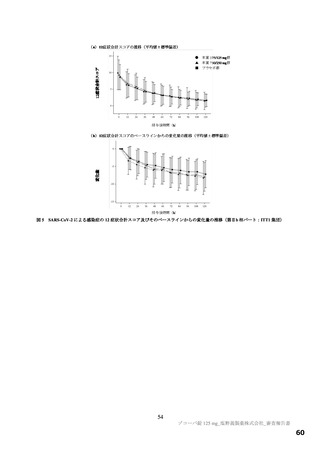
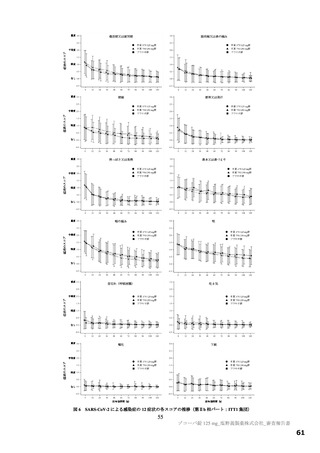
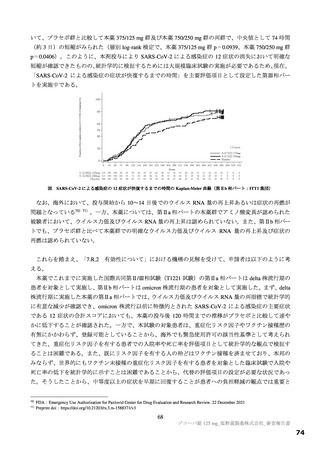
以上の審査を踏まえ、機構は、有効性について、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相パ
ート及び第Ⅱb 相パートの成績に基づき、本薬によりウイルス量が減少する傾向が認められていること
は否定しないが、申請効能・効果に対する有効性が推定できるものとは判断できず、当該試験の第Ⅲ相
パートの結果等を踏まえて改めて検討する必要があると考える。有効性の評価は上記のとおりであるも
のの、医療・社会的観点から、本剤をより早期に使用可能とすることの検討も可能と考える。ただし、
現時点で得られている情報等を踏まえて本剤が承認される場合には、国際共同第Ⅱ/Ⅲ相試験(T1221 試
験)の第Ⅲ相パートの成績等に基づき有効性を再検討し、その結果に応じ、製造販売承認の見直しを含
めた適切な対応を取る必要があると考える。なお、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅲ相パー
トの総括報告書の提出可能時期(予定)は 2022 年 11 月であると申請者が説明していること等を踏まえ、
医薬品医療機器等法第 14 条の 2 の 2 第 1 項における緊急承認の期間は 1 年が適当と考える。
また、本剤が承認される場合には、下記の承認条件を付した上で、承認申請された効能・効果及び用
法・用量を以下のように整備する必要がある。本品目は生物由来製品及び特定生物由来製品のいずれに
も該当せず、原体及び製剤はいずれも劇薬に該当すると判断する。
[効能・効果]
SARS-CoV-2 による感染症
(変更なし)
[用法・用量]
通常、12 歳以上の患者小児及び成人にはエンシトレルビルとして 1 日目は 375 mg を 1 日 1 回、2 日
目から 5 日目は 125 mg を 1 日 1 回、計 5 日間経口投与する。
(申請時より下線部追加、取消線部削除)
[承 認 条 件]
1.
医薬品リスク管理計画を策定の上、適切に実施すること。
2.
本剤の投与が適切と判断される症例のみを対象に、あらかじめ患者又は代諾者に有効性及び安全性
に関する情報が文書をもって説明され、文書による同意を得てから初めて投与されるよう、医師に
対して要請すること。
3.
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅲ相パートについて、終了後速やかに試験成績を提出す
ること。
以上
77
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
83