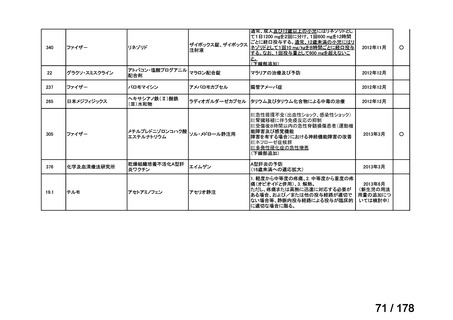
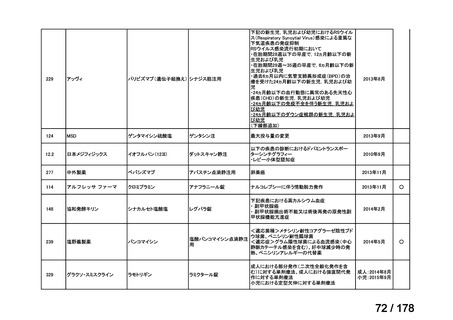
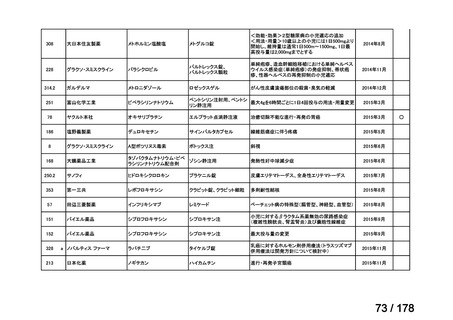
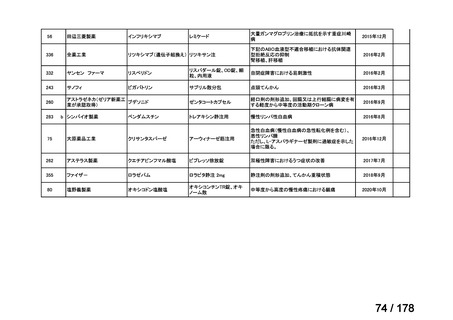
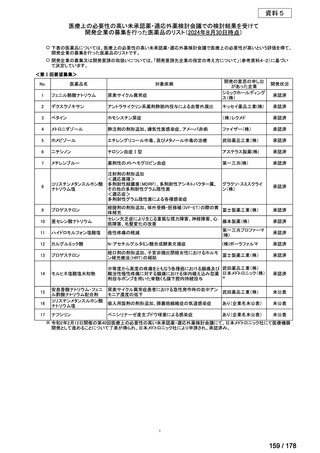
会議資料 (136 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
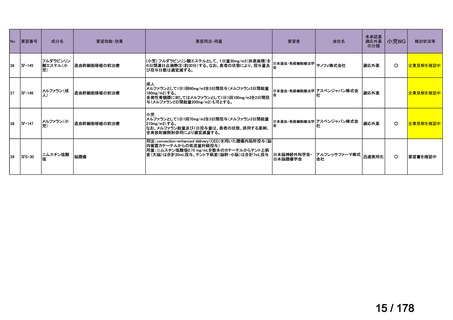
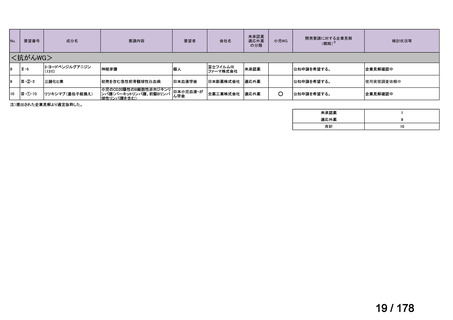
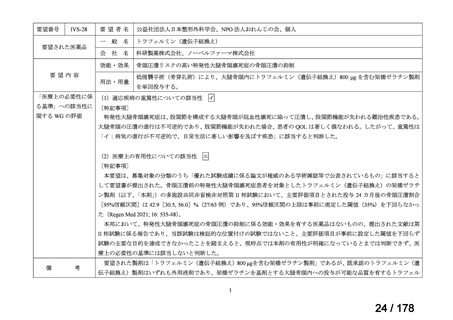
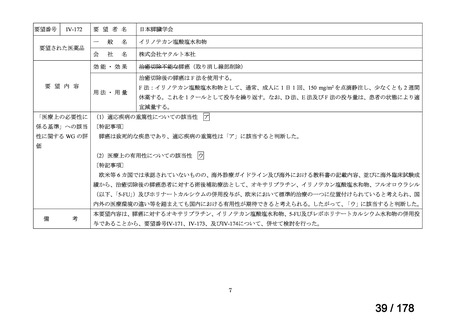
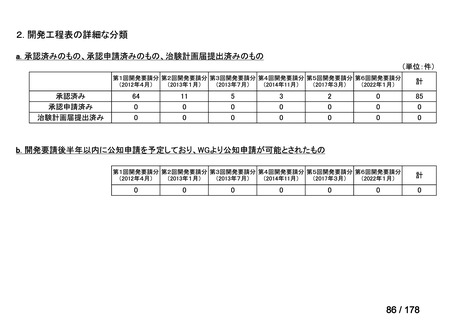
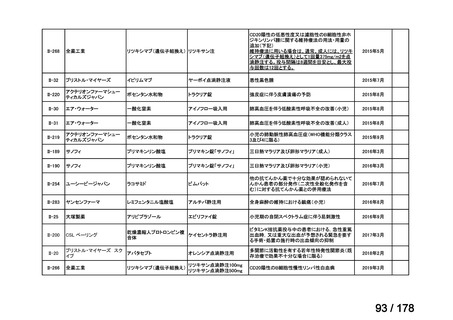
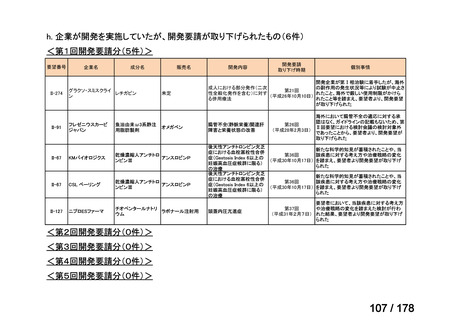
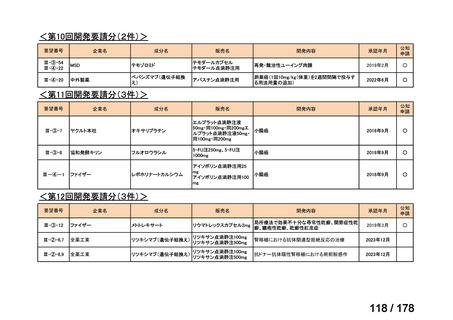
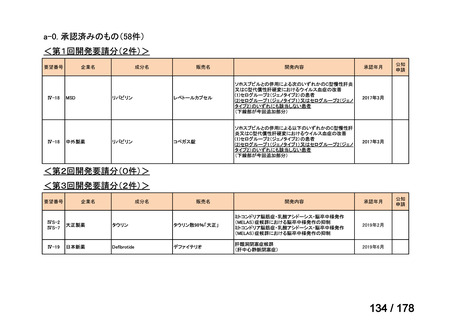
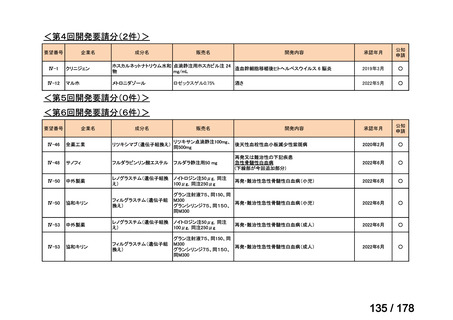
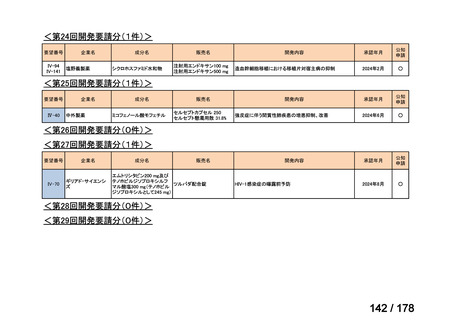
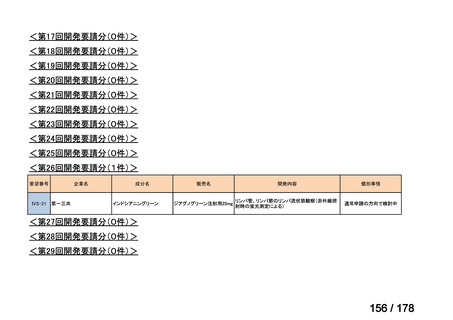
要望番号
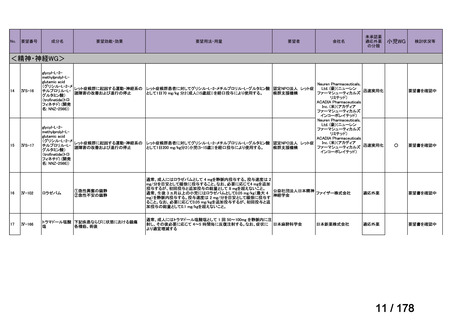
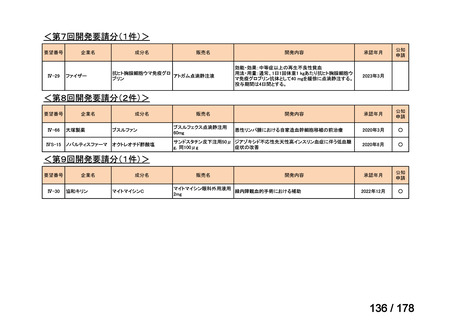
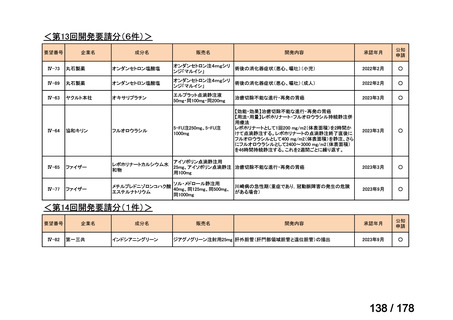
Ⅳ-29
企業名
ファイザー
成分名
販売名
公知
申請
開発内容
承認年月
効能・効果:中等症以上の再生不良性貧血
用法・用量:通常、1日1回体重1 kgあたり抗ヒト胸腺細胞ウ
マ免疫グロブリン抗体として40 mgを緩徐に点滴静注する。
投与期間は4日間とする。
2023年3月
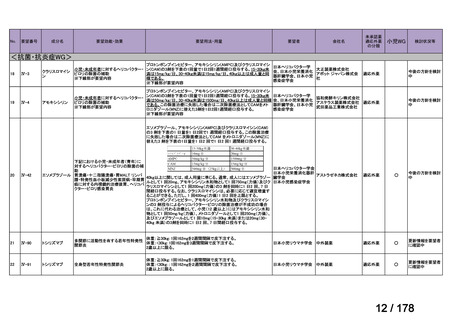
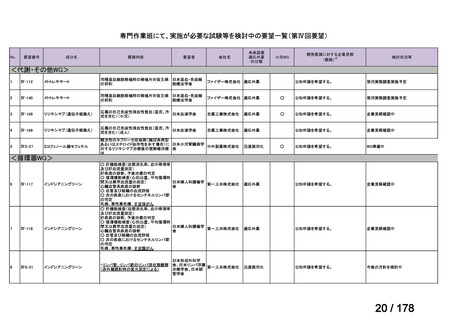
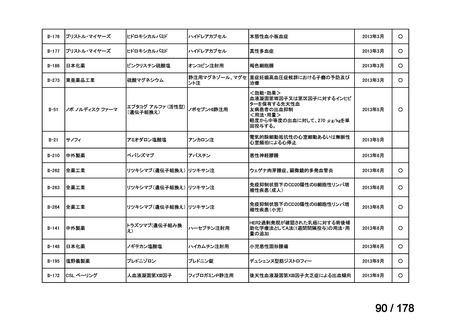
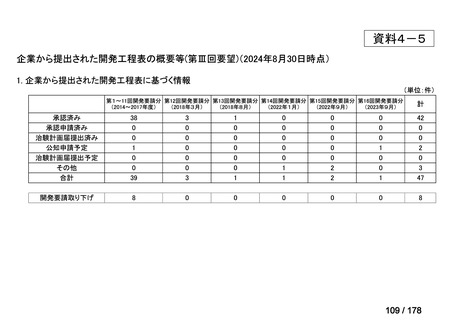
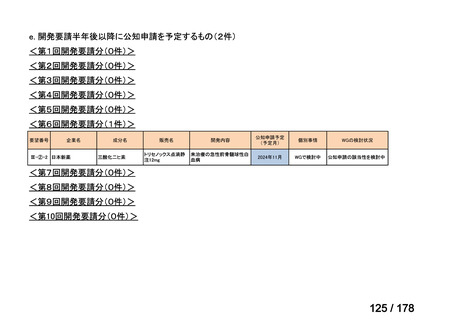
開発内容
承認年月
公知
申請
2020年3月
○
2020年8月
○
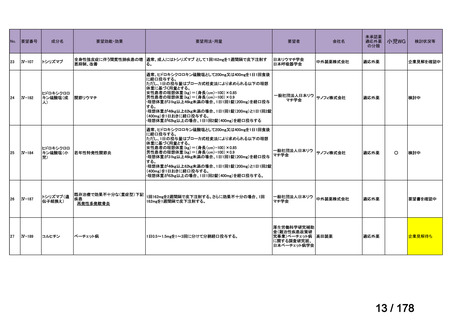
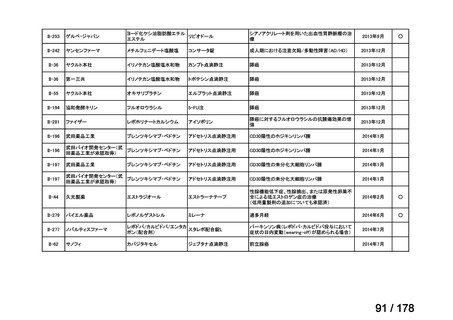
開発内容
承認年月
公知
申請
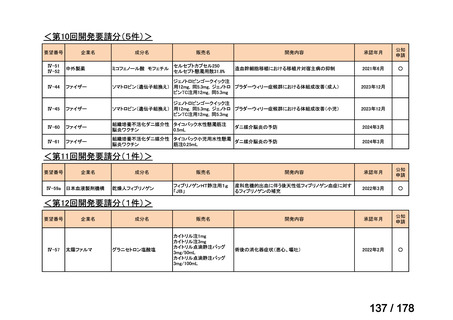
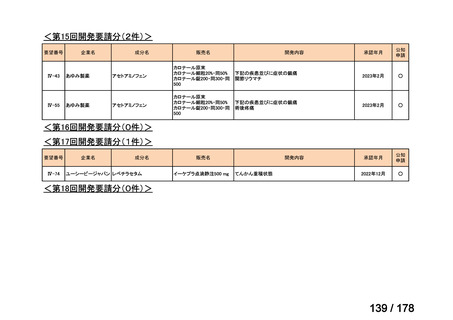
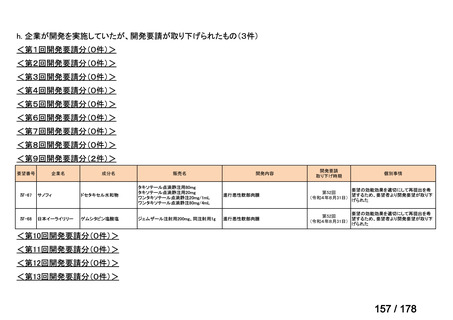
マイトマイシン眼科外用液用
緑内障観血的手術における補助
2mg
2022年12月
○
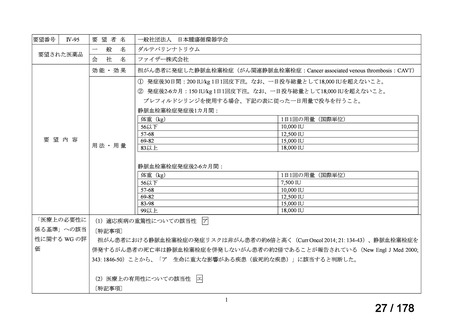
抗ヒト胸腺細胞ウマ免疫グロ
アトガム点滴静注液
ブリン
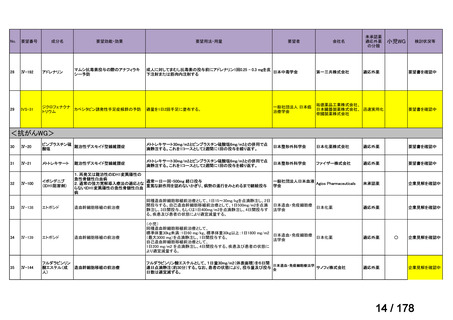
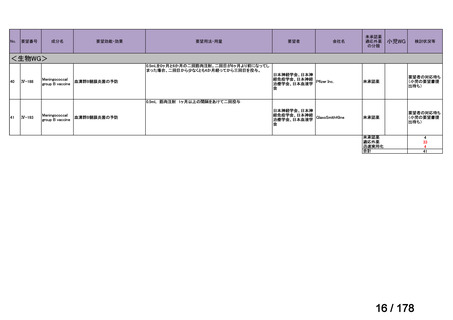
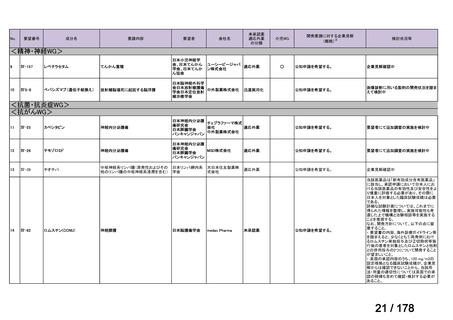
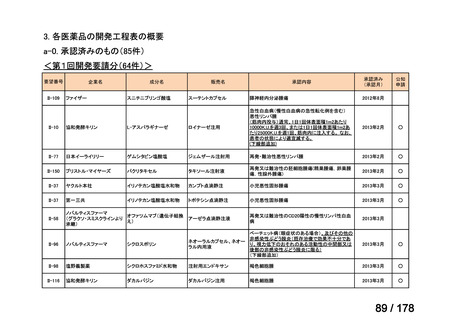
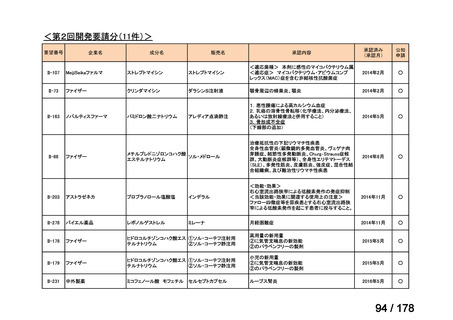
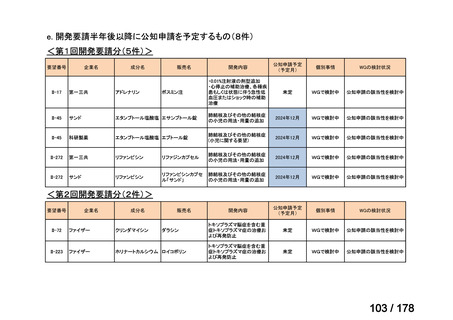
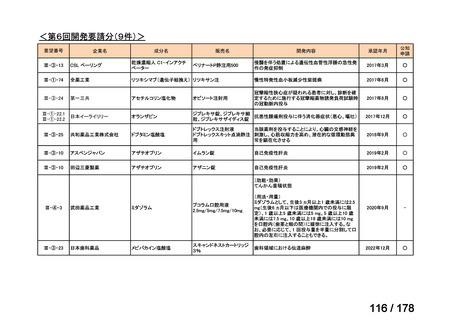
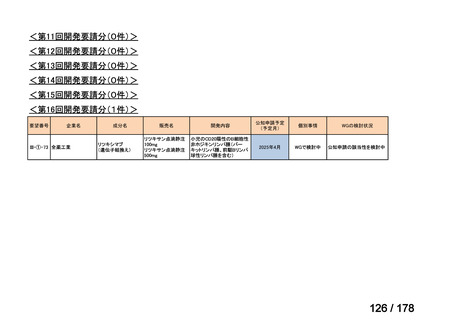
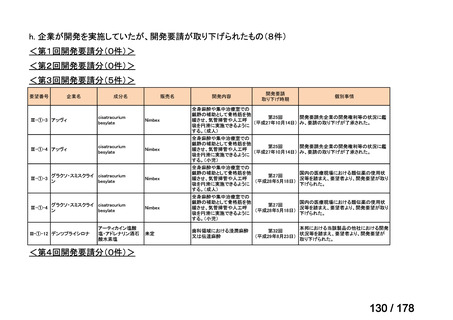
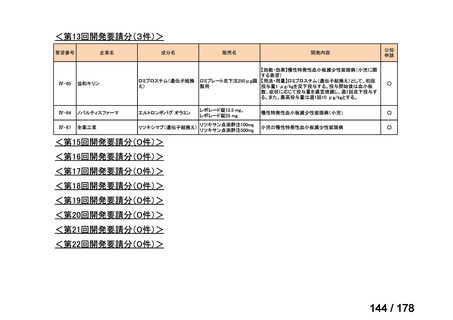
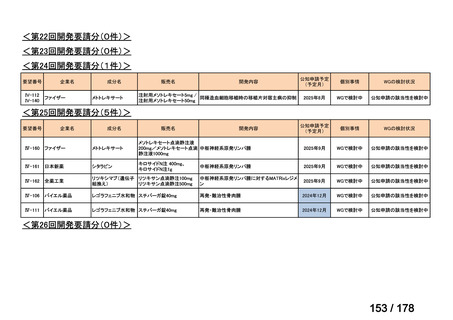
<第8回開発要請分(2件)>
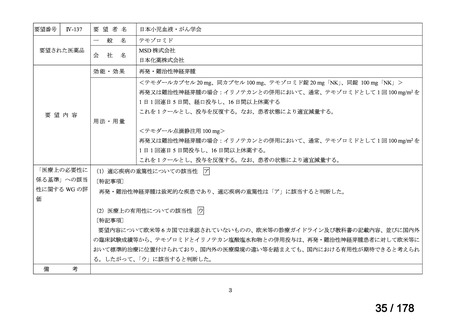
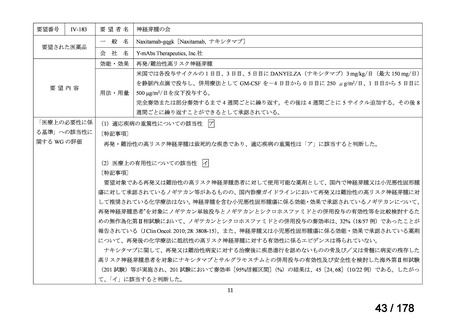
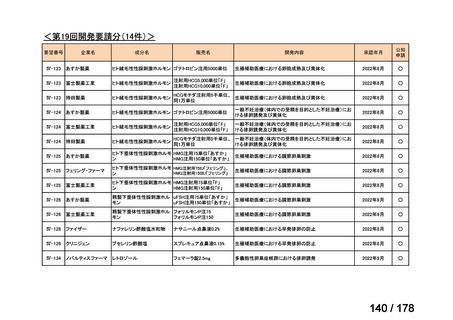
要望番号
Ⅳ-66
企業名
大塚製薬
ⅣS-15 ノバルティスファーマ
成分名
販売名
ブスルファン
ブスルフェクス点滴静注用
60mg
オクトレオチド酢酸塩
サンドスタチン皮下注用50μ ジアゾキシド不応性先天性高インスリン血症に伴う低血糖
g,同100μg
症状の改善
悪性リンパ腫における自家造血幹細胞移植の前治療
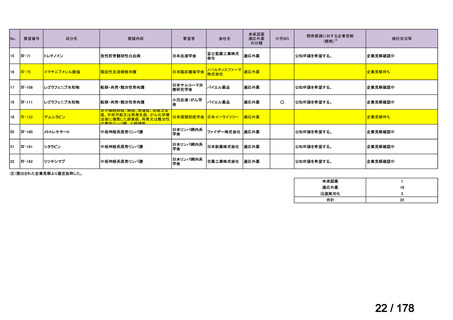
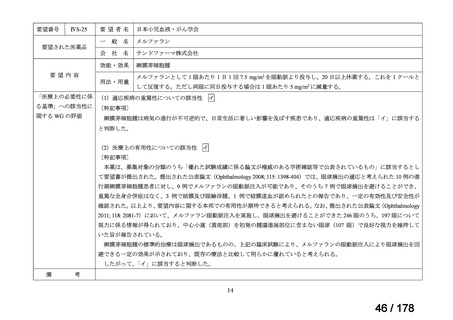
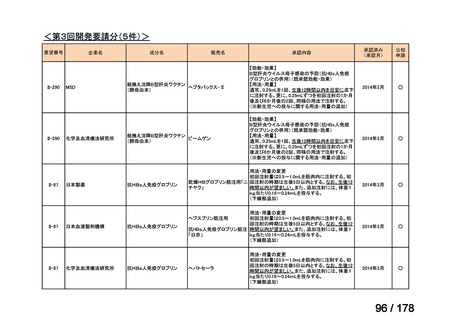
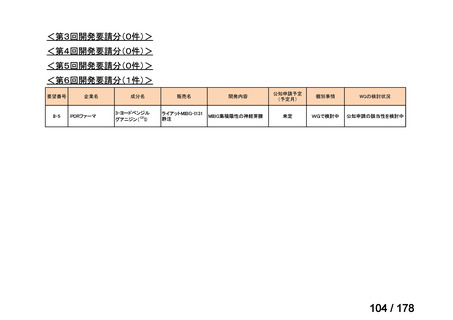
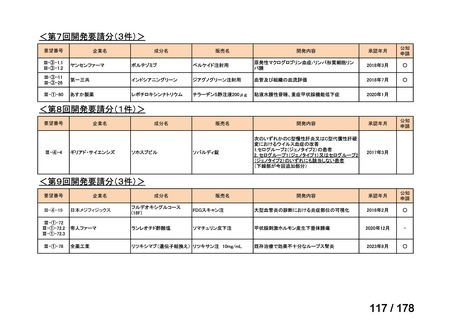
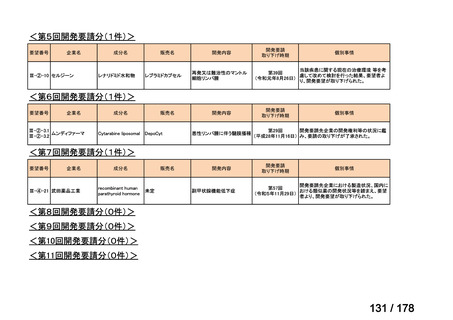
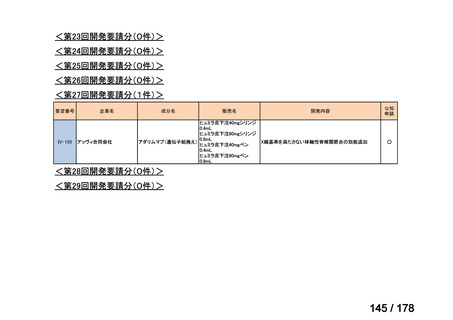
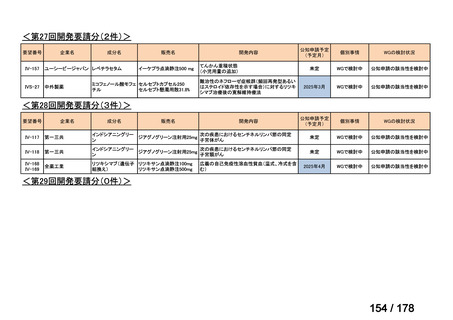
<第9回開発要請分(1件)>
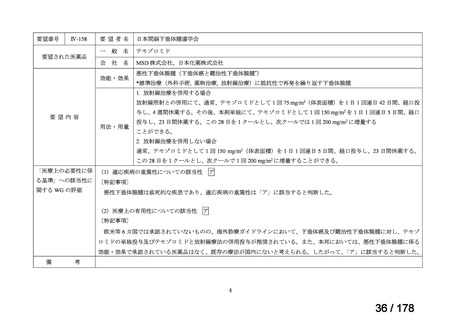
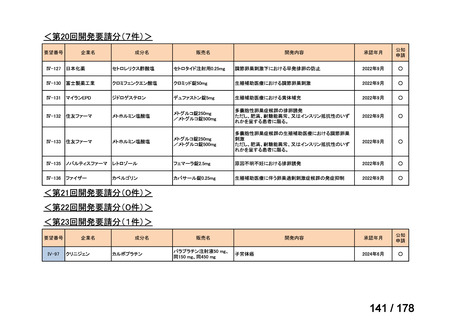
要望番号
Ⅳ-30
企業名
協和キリン
成分名
マイトマイシンC
販売名
136 / 178