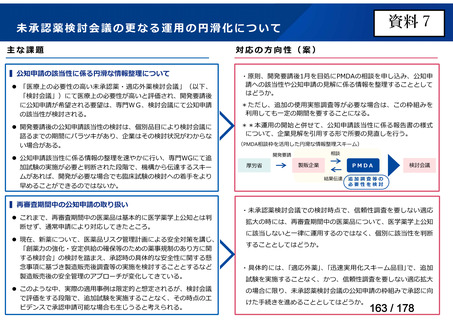
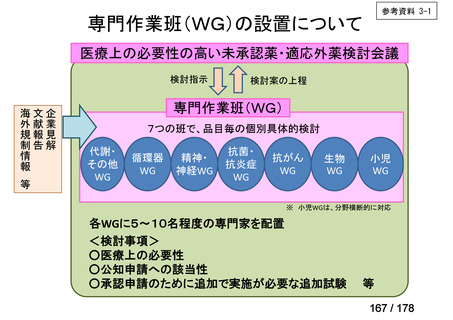
会議資料 (48 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
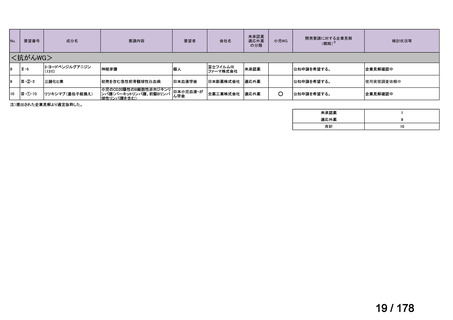
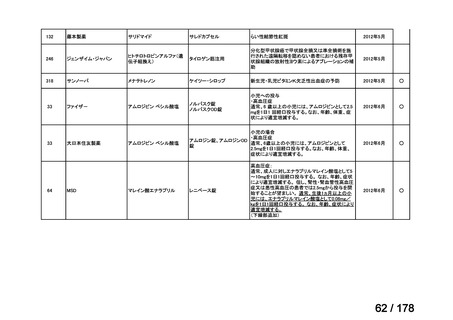
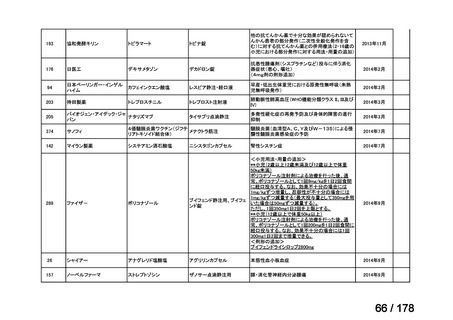
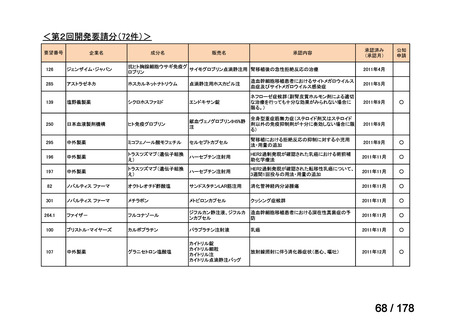
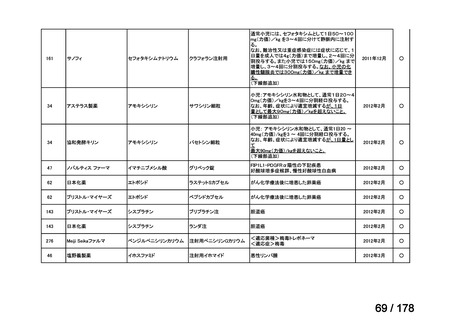
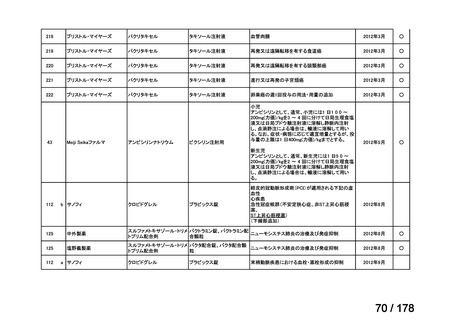
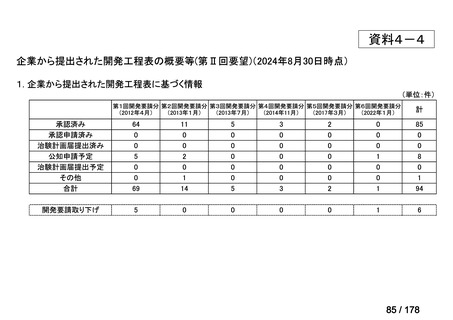
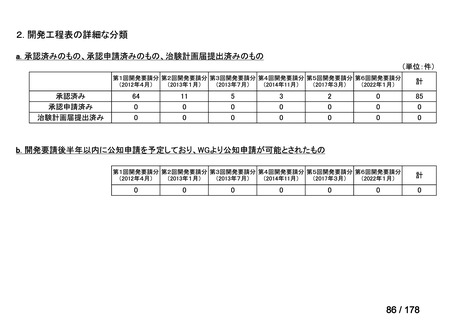
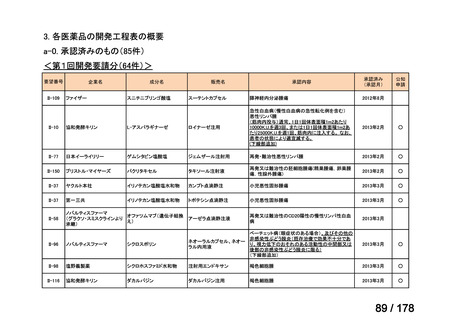
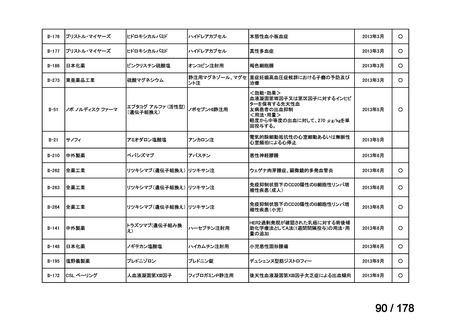
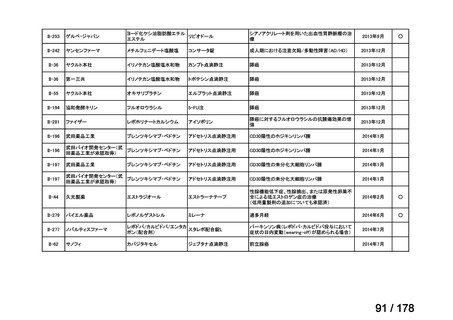
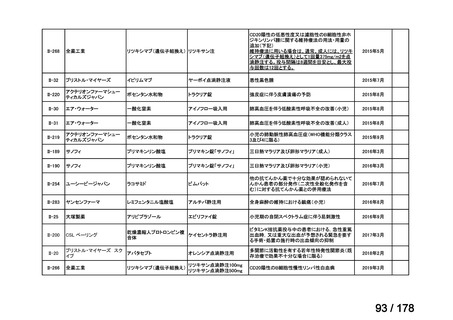
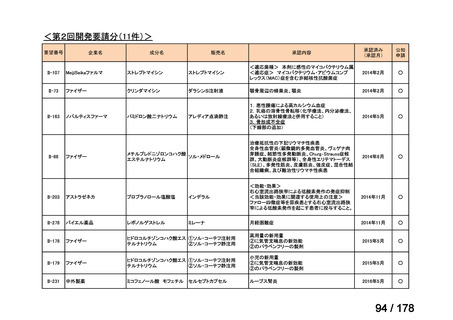
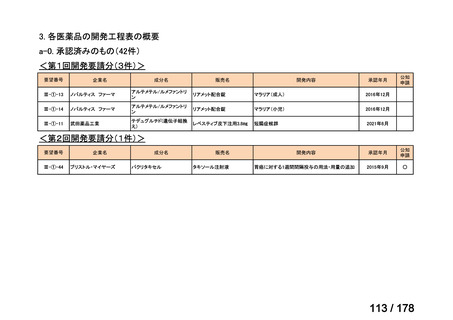
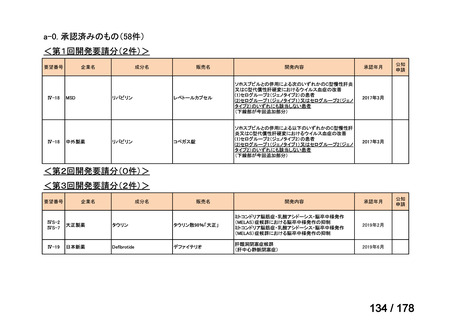
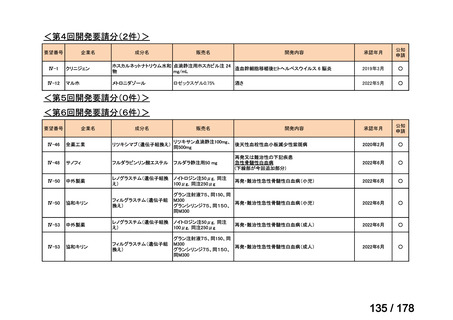
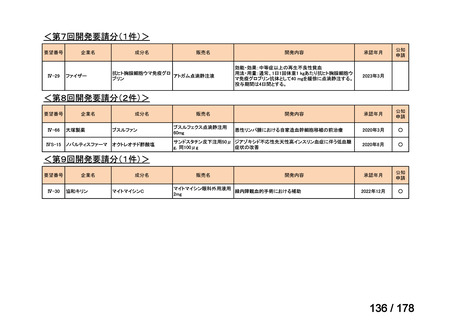
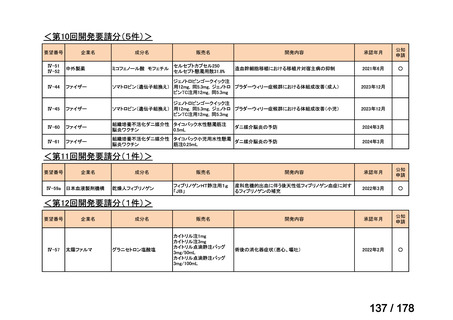
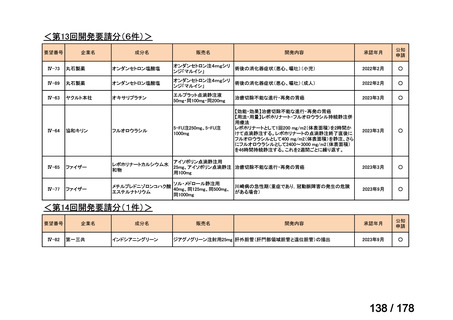
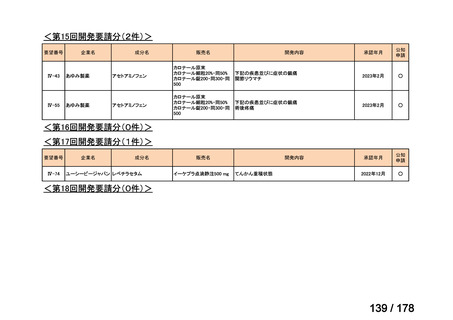
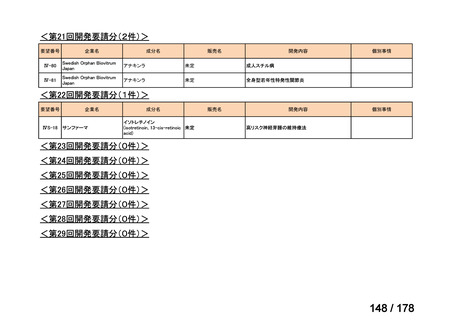
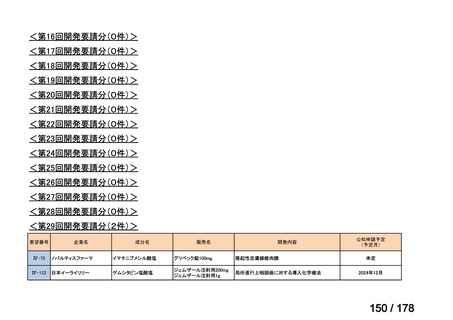
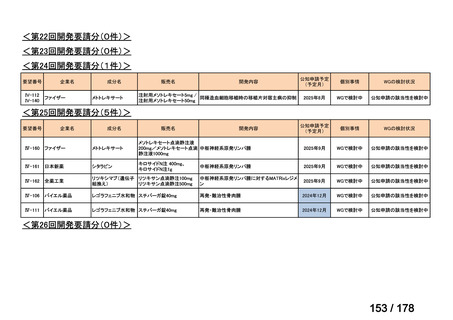
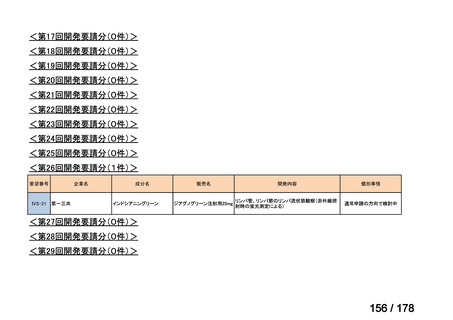
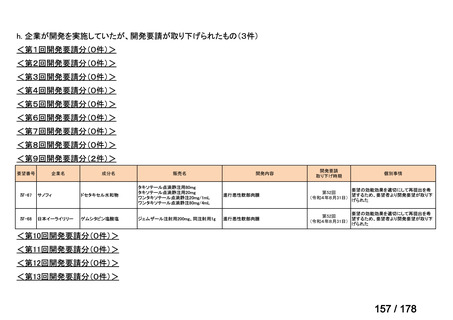
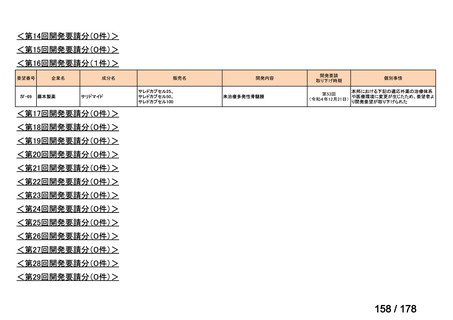
(2)第Ⅱ回要望分開発要請品目(開発要請時:2012 年 4 月、2013 年 1 月、2013 年 7
月、2014 年 11 月、2017 年 3 月、2022 年 1 月)
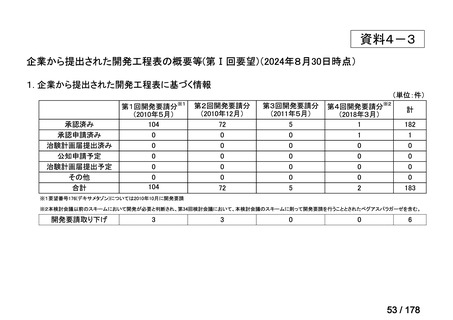
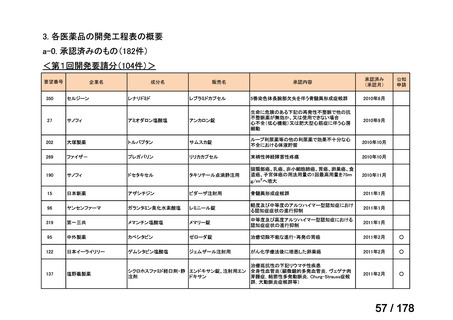
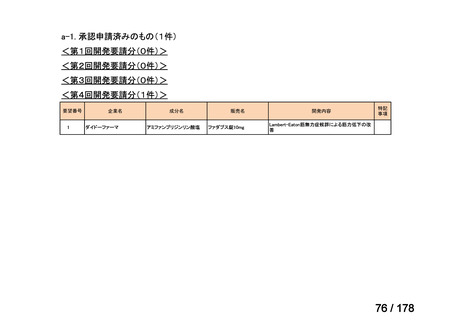
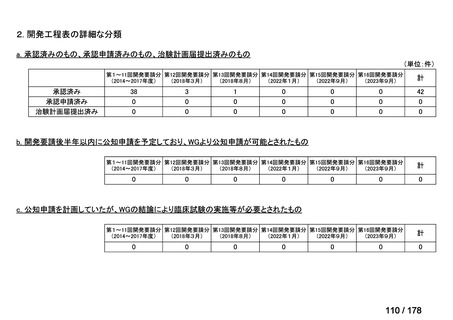
①. 開発要請時に既に承認申請済みのもの及び治験計画届提出済みのものについては、企
業が開発要請を受けた未承認薬・適応外薬の開発を適切に行ったものと評価する。ただ
し、治験計画届提出済みのものについては、開発計画に従って適切に開発を行っている
か定期的に評価を行う。
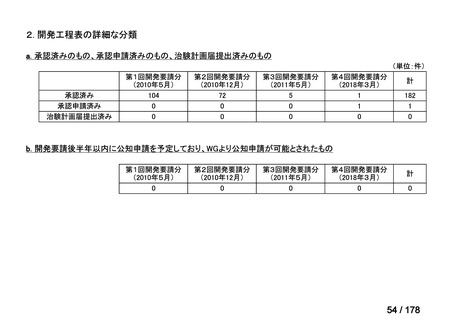
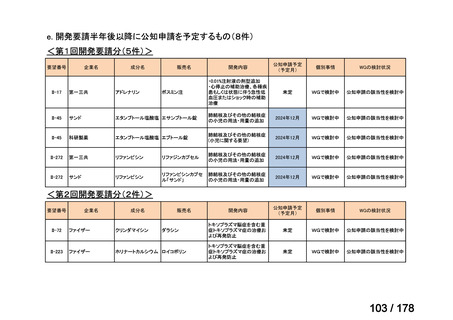
②. 開発要請から半年以内に WG の結論により公知申請が可能とされたものについて
は、開発を適切に行ったものと評価する。
③. 公知申請予定のもので、使用実態調査が必要とされたもの等、特段の事情がある場合
は、その事情、行政側持ち時間等を考慮して個別に評価を行う。なお、公知申請の該当
性について WG の結論が出ていないものについては、今回は評価を行わない。
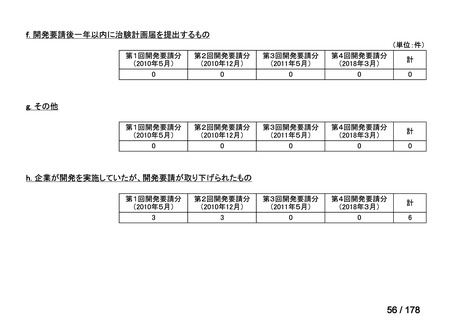
④. 開発要請から 1 年以内に治験計画届を提出したもの又は治験計画届提出予定としたも
のについては、開発を適切に行ったものと評価し、さらに治験計画届提出以降は開発計
画に従って適切に開発を行っているか定期的に評価を行う。
⑤. 公知申請には該当しないが、治験を実施せず、既存データを用いて承認申請をする場
合は、④に準じ、開発要請から 1 年以内に承認申請したもの又は申請予定としたものに
ついて、開発を適切に行ったものと評価する。
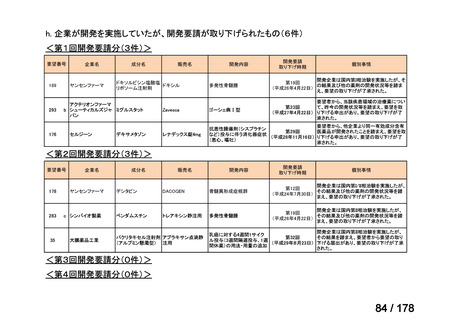
⑥. その他については、開発計画ごとの個別の事情や、行政側持ち時間等を考慮して個別
に評価を行う。
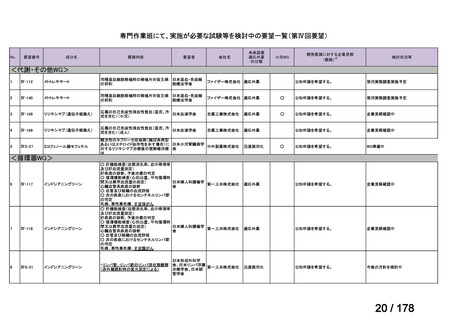
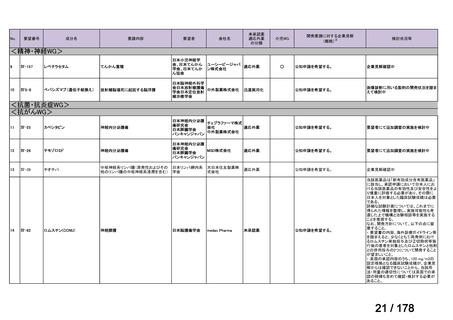
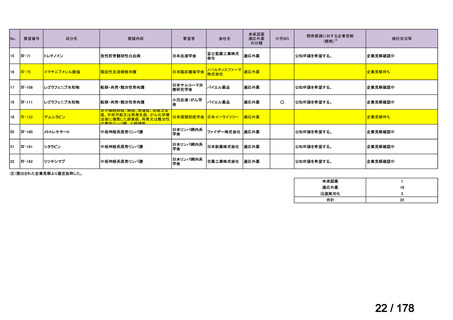
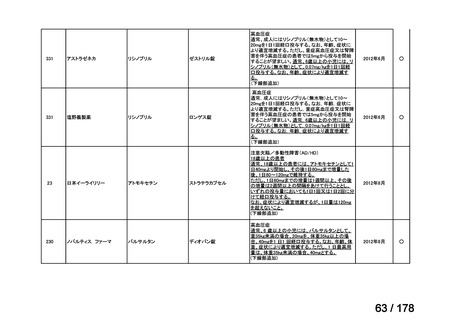
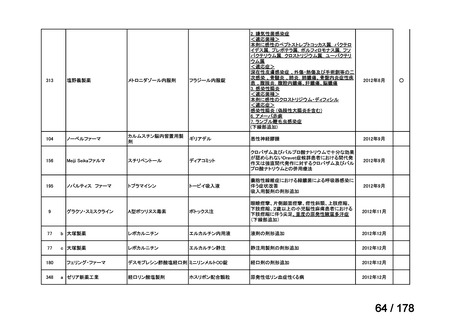
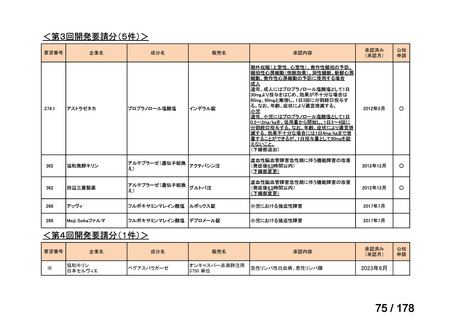
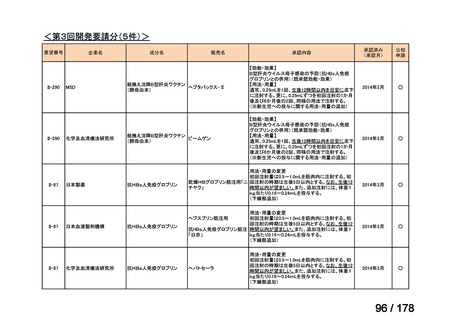
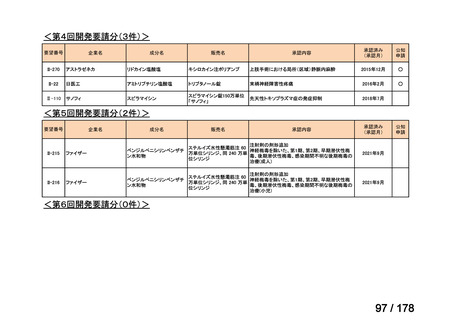
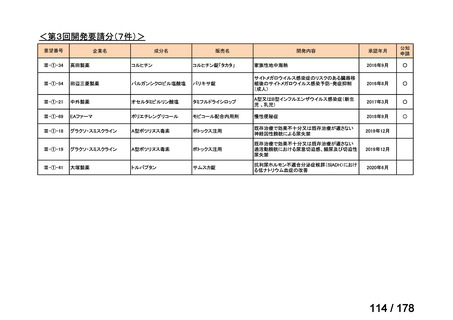
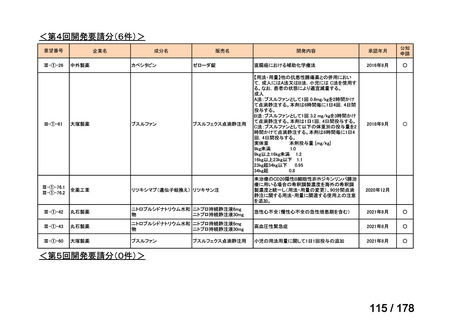
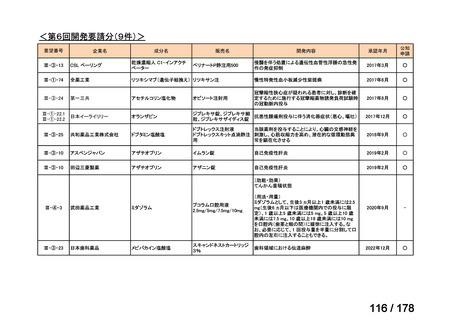
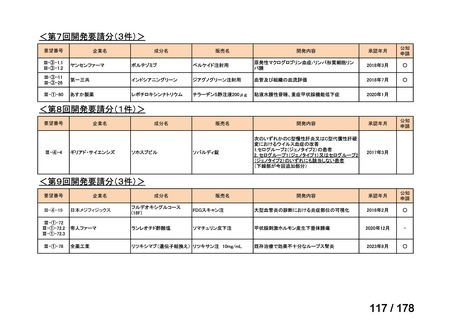
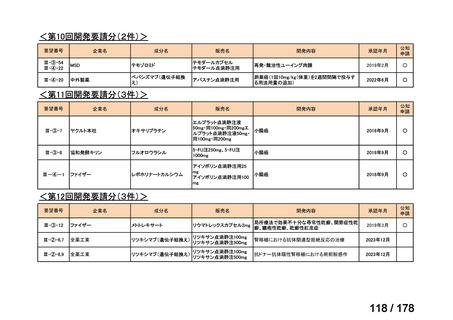
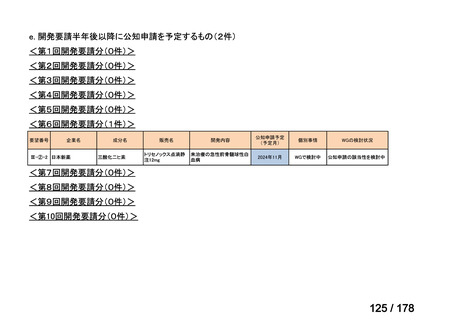
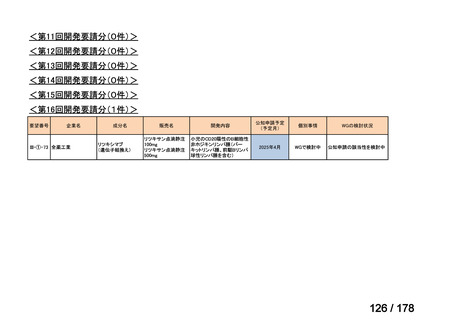
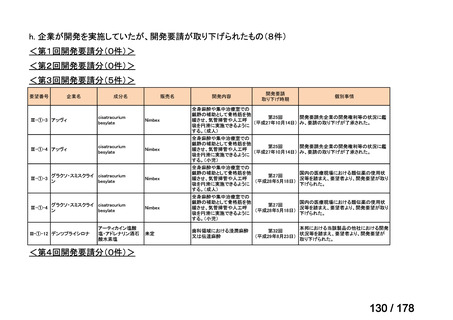
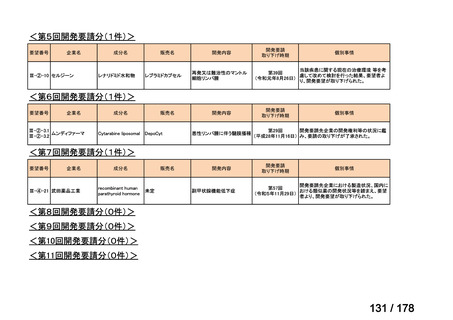
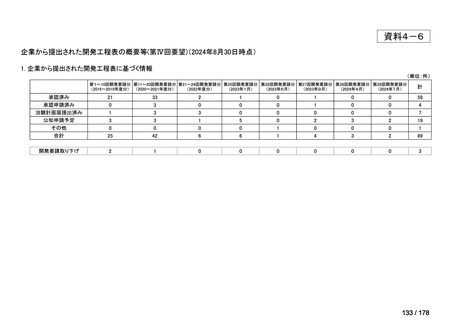
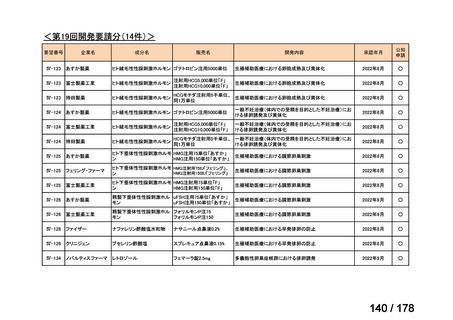
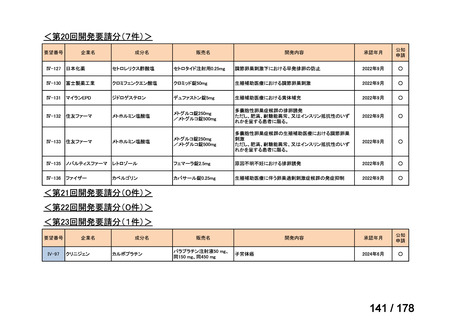
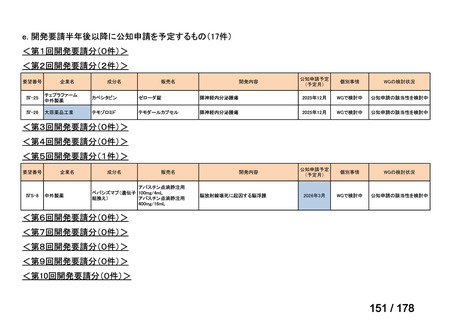
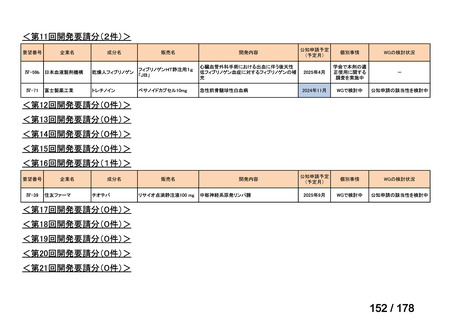
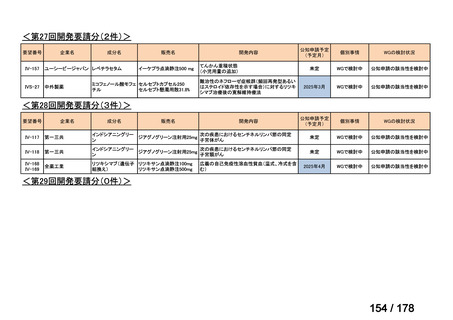
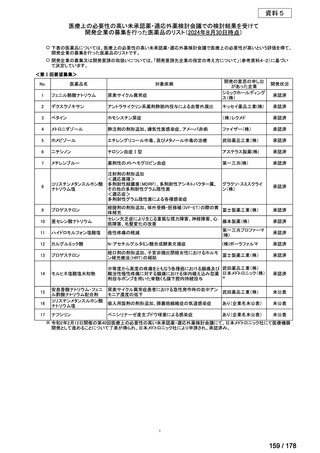
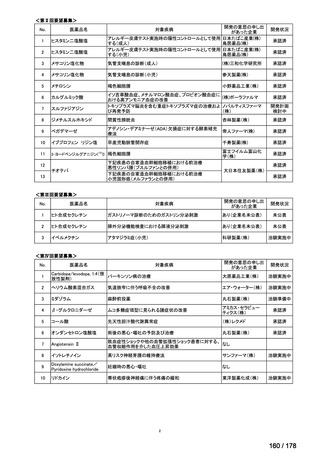
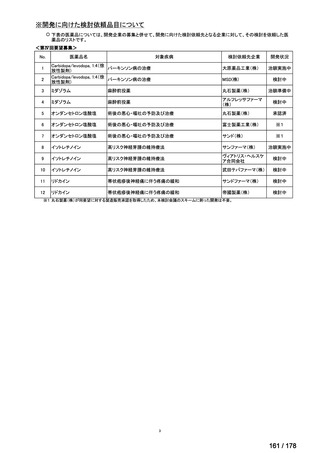
(3)第Ⅲ回要望分開発要請品目(開発要請時:2014 年 8 月、2014 年 11 月、2015 年 5
月、2015 年 8 月、2015 年 11 月、2016 年 2 月、2016 年 6 月、2016 年 8 月、2016 年
11 月、2017 年 3 月、2017 年 8 月、2018 年 3 月、2018 年 8 月、2022 年 1 月、2022
年 9 月、2023 年 9 月)
①. 開発要請時に既に承認申請済みのもの及び治験計画届提出済みのものについては、企
業が開発要請を受けた未承認薬・適応外薬の開発を適切に行ったものと評価する。ただ
し、治験計画届提出済みのものについては、開発計画に従って適切に開発を行っている
か定期的に評価を行う。
②. 開発要請から半年以内に WG の結論により公知申請が可能とされたもの及び公知申
請予定としたものについては、開発を適切に行ったものと評価する。
③. 公知申請予定のもので、使用実態調査が必要とされたもの等、特段の事情がある場合
は、その事情、行政側持ち時間等を考慮して個別に評価を行う。なお、公知申請の該当
性について WG の結論が出ていないものについては、今回は評価を行わない。
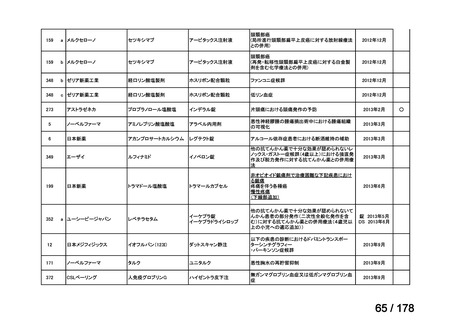
④. 開発要請から 1 年以内に治験計画届を提出したもの又は治験計画届提出予定としたも
のについては、開発を適切に行ったものと評価し、さらに治験計画届提出以降は開発計
画に従って適切に開発を行っているか定期的に評価を行う。
⑤. 公知申請には該当しないが、治験を実施せず、既存データを用いて承認申請をする場
合は、④に準じ、開発要請から 1 年以内に承認申請したもの又は申請予定としたものに
ついて、開発を適切に行ったものと評価する。
⑥. その他については、開発計画ごとの個別の事情や、行政側持ち時間等を考慮して個別
2
48 / 178