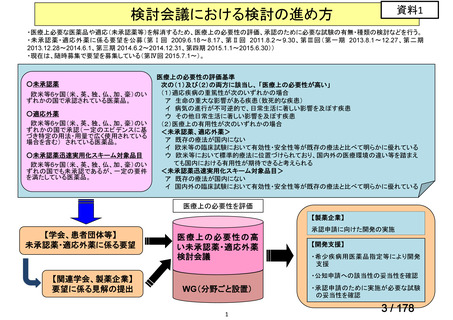
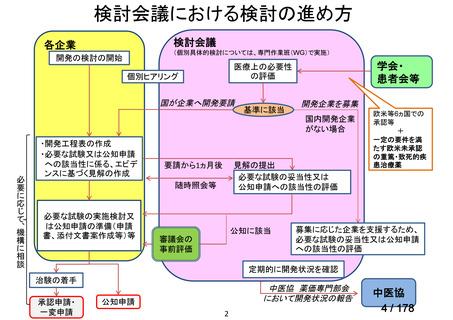
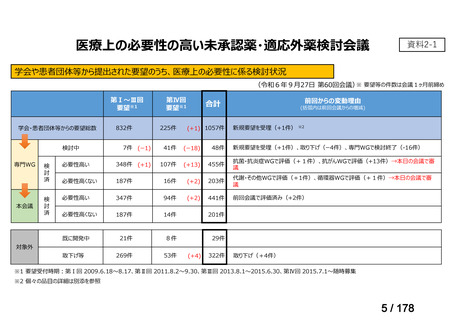
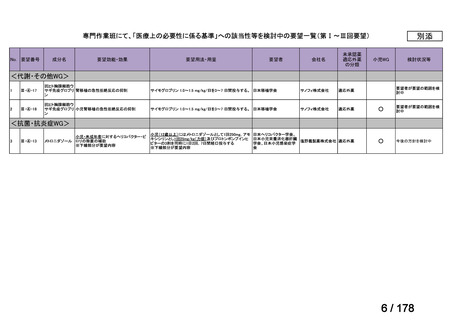
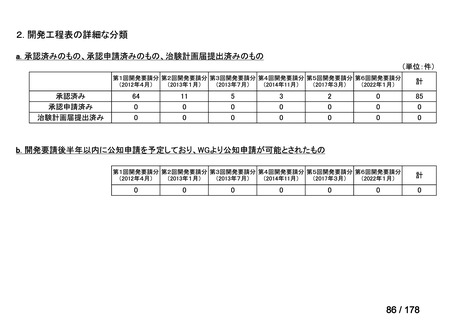
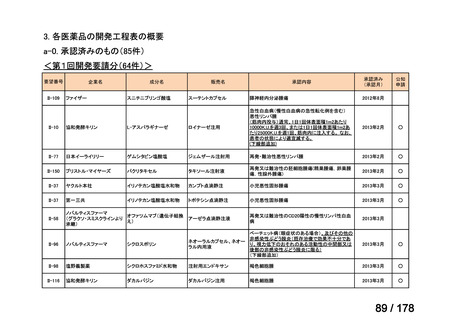
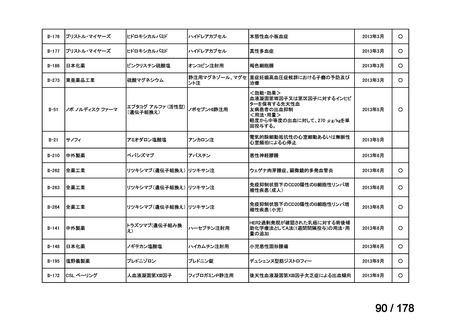
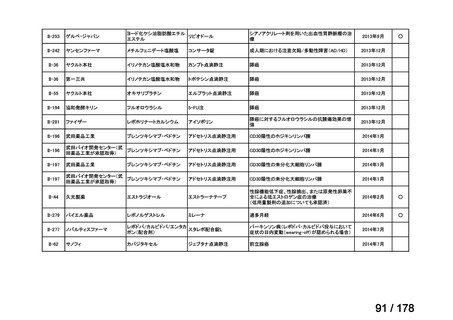
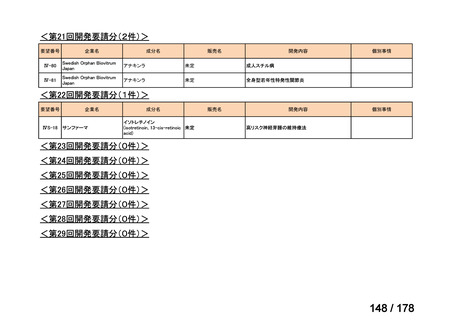
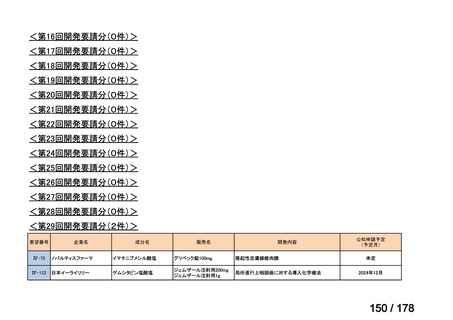
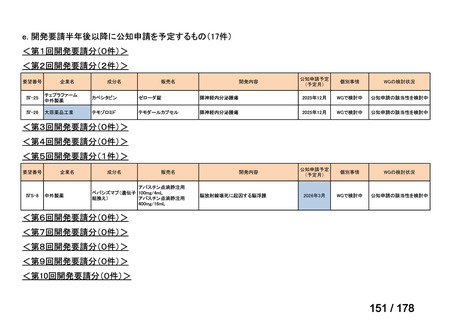
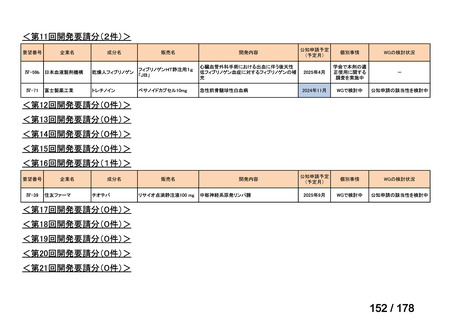
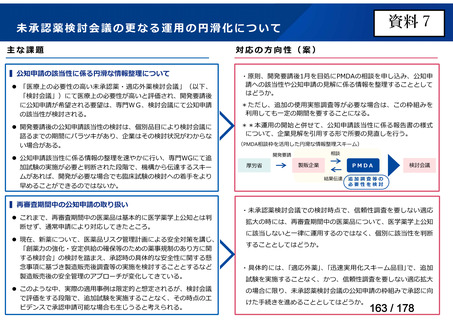
会議資料 (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
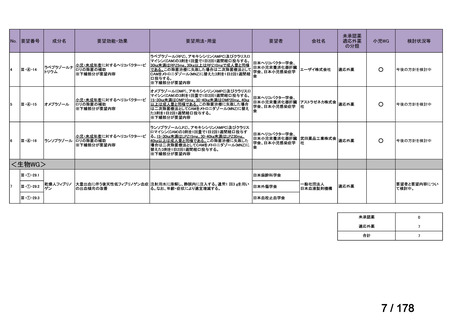
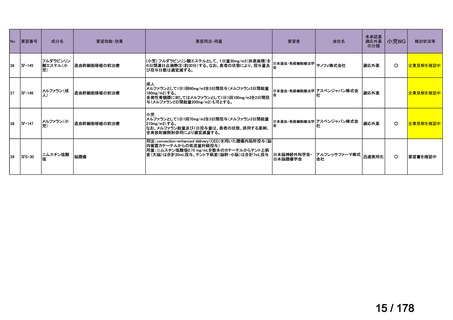
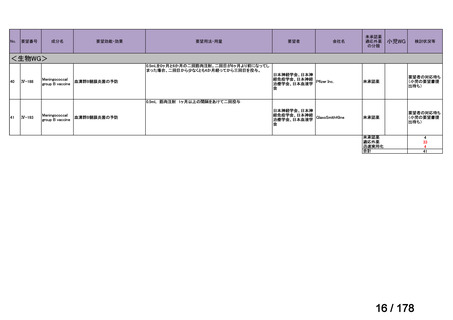
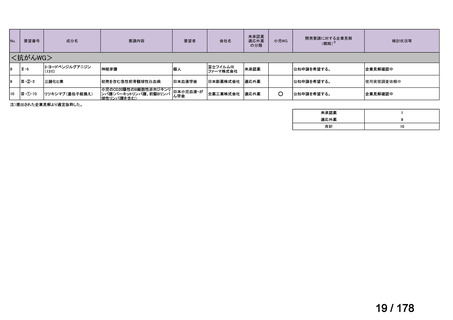
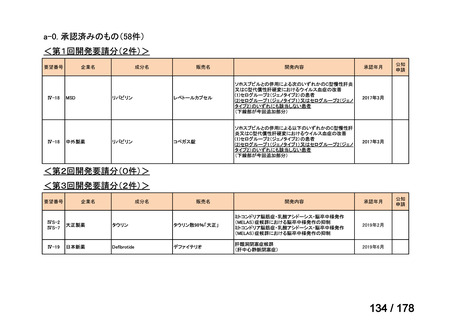
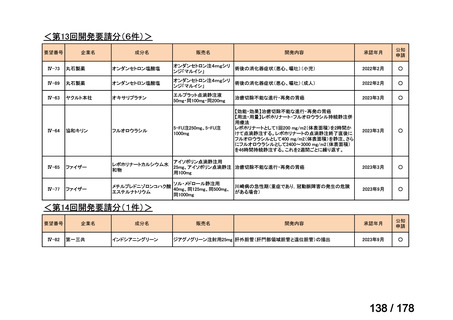
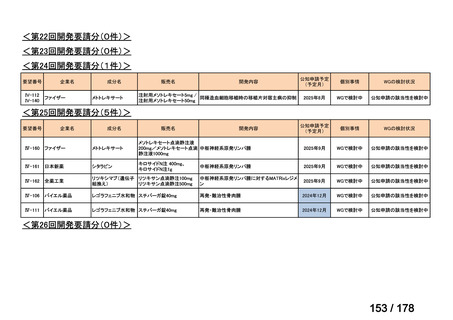
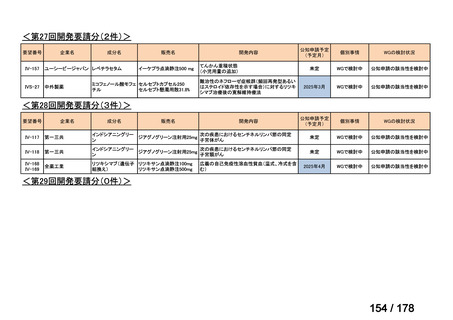
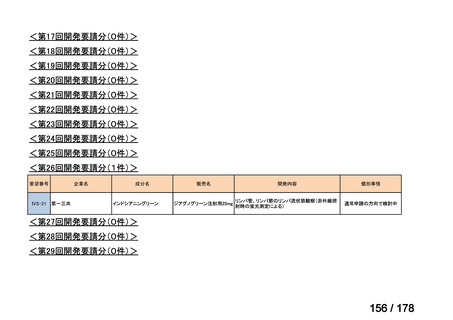
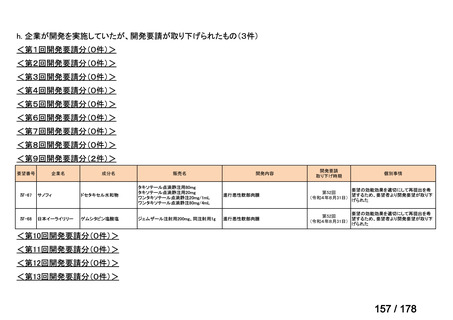
Ⅳ-183
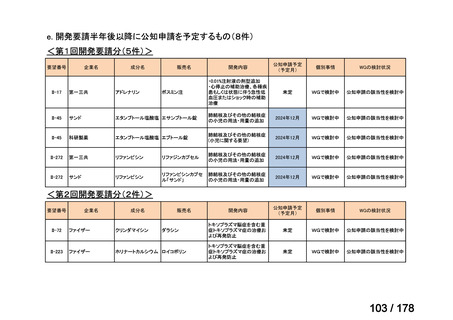
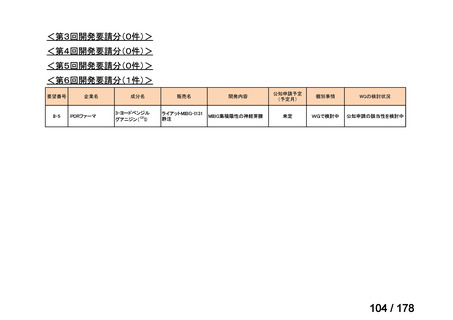
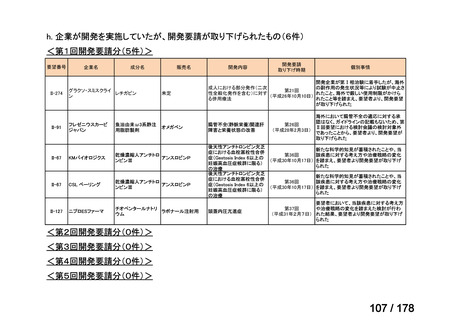
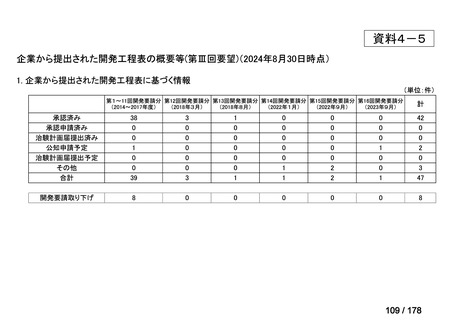
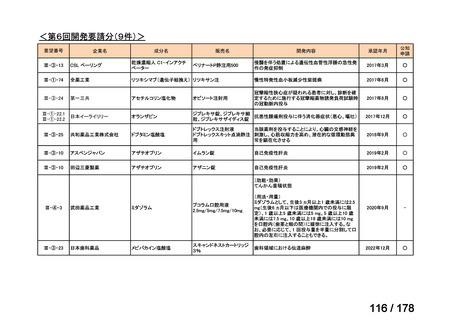
要望された医薬品
要望者名
神経芽腫の会
一
般
名
Naxitamab-gqgk[Naxitamab, ナキシタマブ]
会
社
名
Y-mAbs Therapeutics, Inc.社
効能・効果
再発/難治性高リスク神経芽腫
米国では各投与サイクルの 1 日目、3 日目、5 日目に DANYELZA(ナキシタマブ)3 mg/kg/日(最大 150 mg/日)
要望内容
を静脈内点滴で投与し、併用療法として GM-CSF を-4 日目から 0 日目に 250 μg/m2/日、1 日目から 5 日目に
用法・用量
500 μg/m2/日を皮下投与する。
完全奏効または部分奏効するまで 4 週間ごとに繰り返す。その後は 4 週間ごとに 5 サイクル追加する。その後 8
週間ごとに繰り返すことができるとして承認されている。
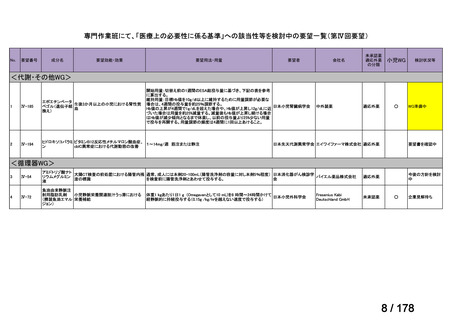
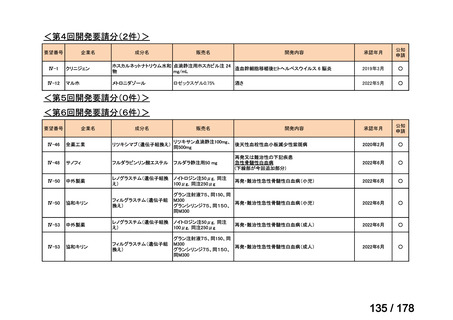
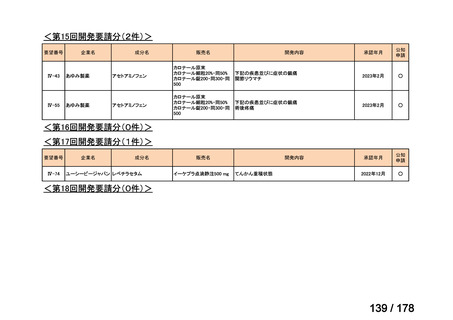
「医療上の必要性に係 (1)適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ア
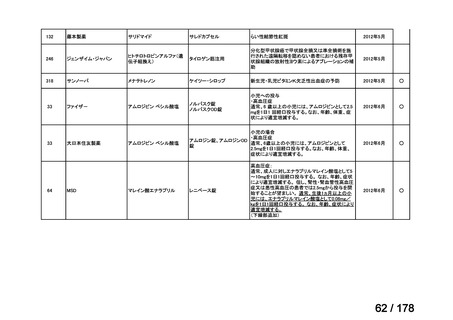
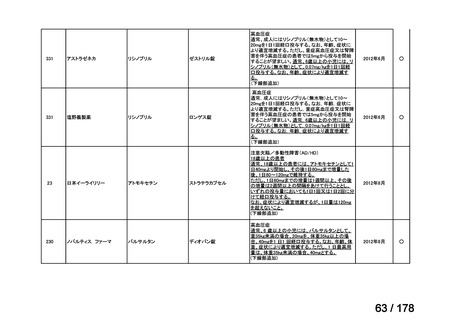
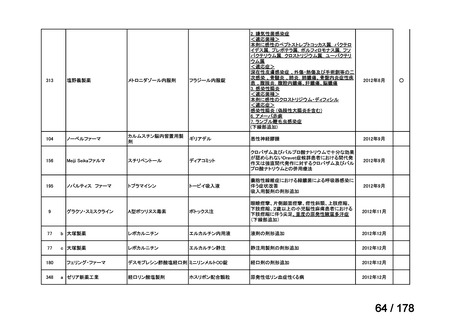
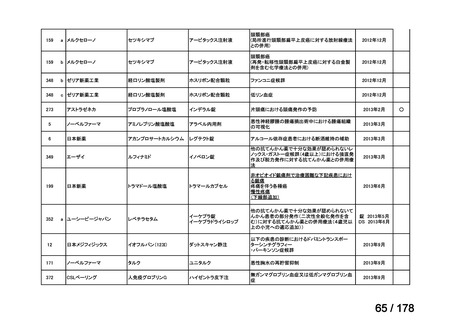
再発・難治性の高リスク神経芽腫は致死的な疾患であり、適応疾病の重篤性は「ア」に該当すると判断した。
(2)医療上の有用性についての該当性
イ
〔特記事項〕
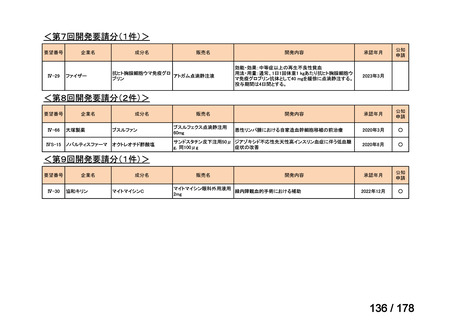
要望対象である再発又は難治性の高リスク神経芽腫患者に対して使用可能な薬剤として、国内で神経芽腫又は小児悪性固形腫
瘍に対して承認されているノギテカン等があるものの、国内診療ガイドラインにおいて再発又は難治性の高リスク神経芽腫に対
して推奨されている化学療法はない。神経芽腫を含む小児悪性固形腫瘍に係る効能・効果で承認されているノギテカンについて、
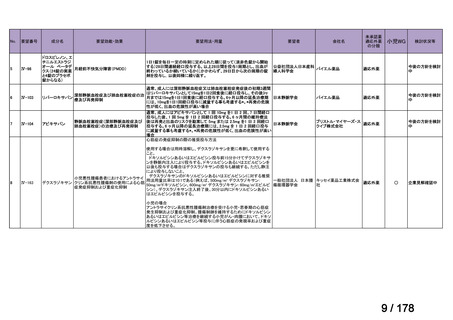
再発神経芽腫患者*を対象にノギテカン単独投与とノギテカンとシクロホスファミドとの併用投与の有効性等を比較検討するた
めの無作為化第Ⅱ相試験において、ノギテカンとシクロホスファミドとの併用投与の奏効率は、32%(18/57 例)であったことが
報告されている(J Clin Oncol. 2010; 28: 3808-15)
。また、神経芽腫又は小児悪性固形腫瘍に係る効能・効果で承認されている薬剤
について、再発後の化学療法に抵抗性の高リスク神経芽腫に対する有効性に係るエビデンスは得られていない。
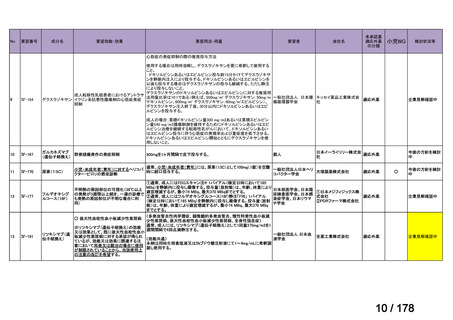
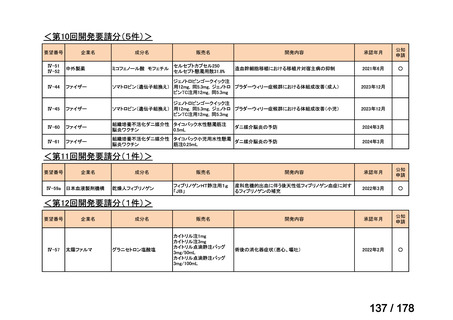
ナキシタマブに関して、再発又は難治性病変に対する治療後に疾患進行を認めないものの骨及び/又は骨髄に病変の残存した
高リスク神経芽腫患者を対象にナキシタマブとサルグラモスチムとの併用投与の有効性及び安全性を検討した海外第Ⅱ相試験
(201 試験)等が実施され、201 試験において奏効率[95%信頼区間]
(%)の結果は、45[24, 68]
(10/22 例)である。したがっ
て、「イ」に該当すると判断した。
11
43 / 178