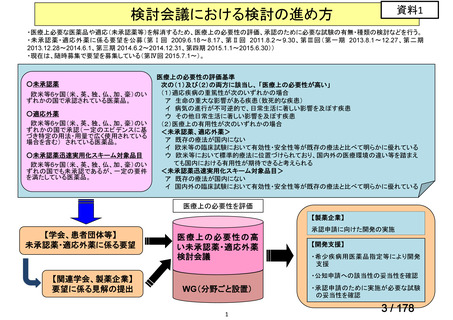
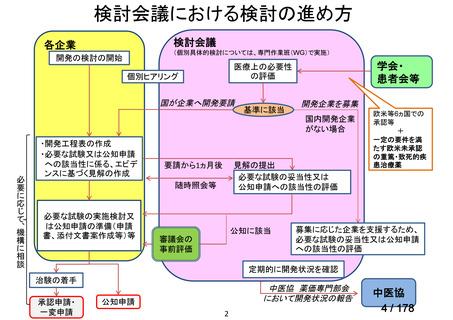
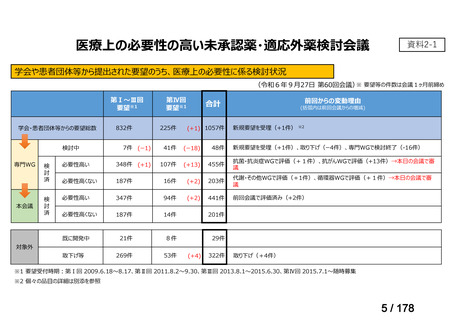
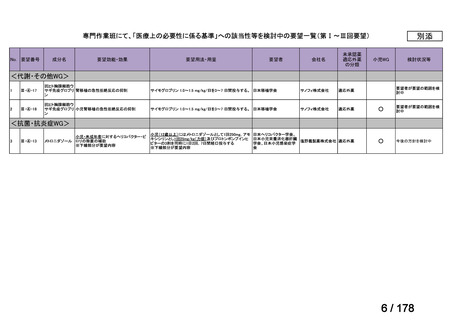
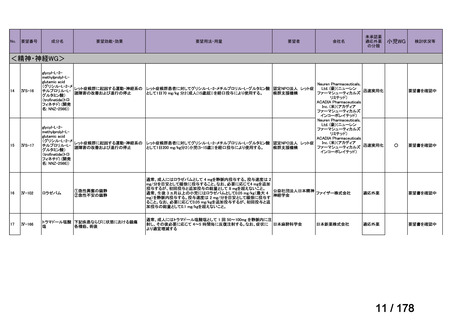
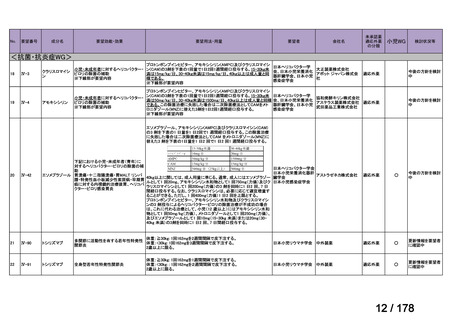
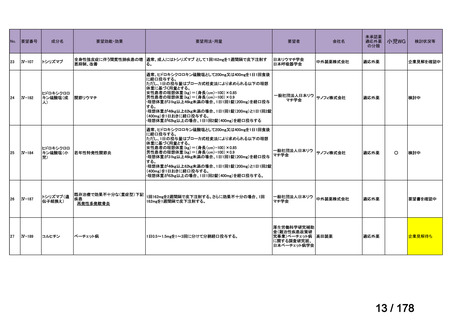
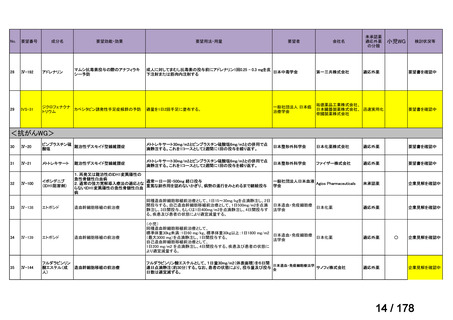
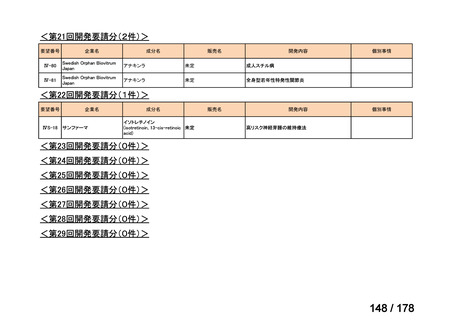
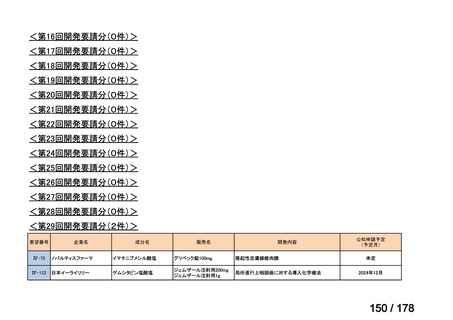
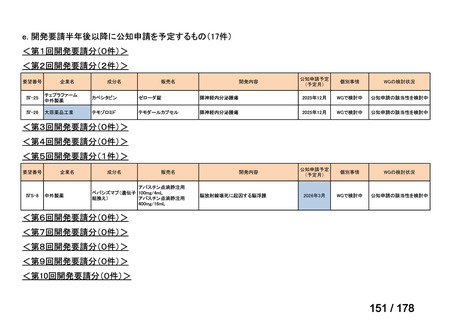
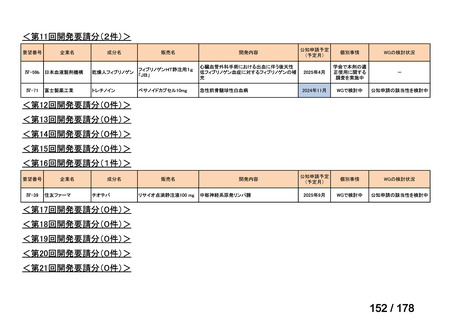
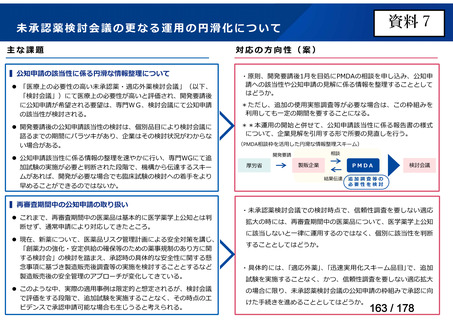
会議資料 (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
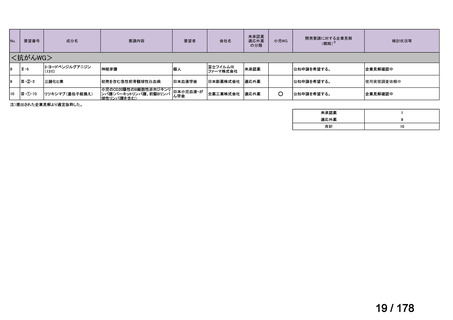
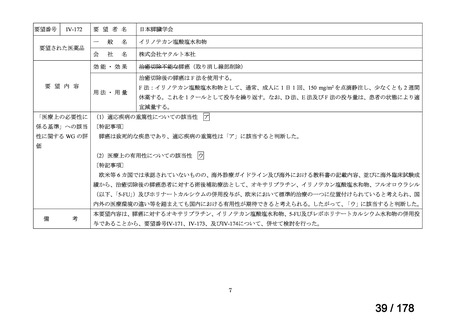
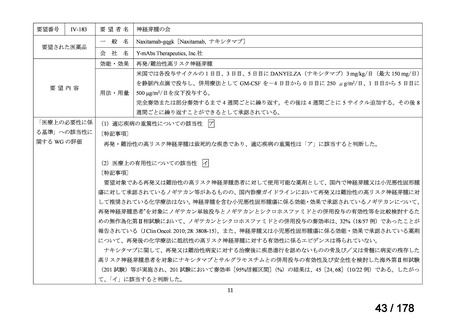
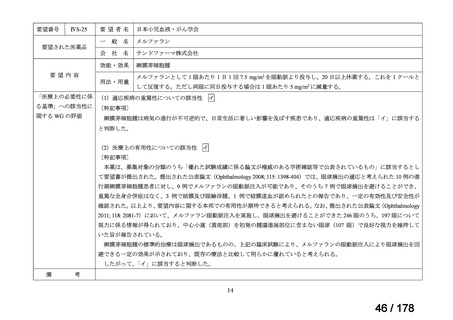
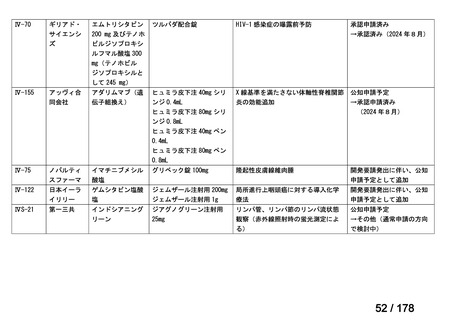
IVS-28
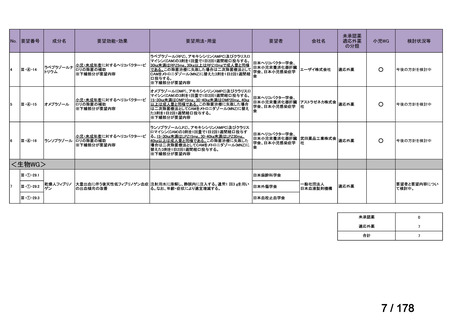
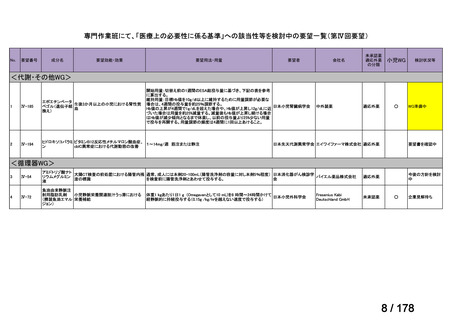
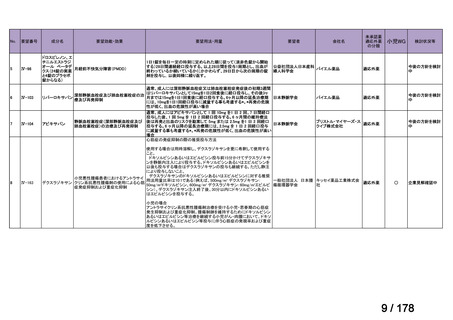
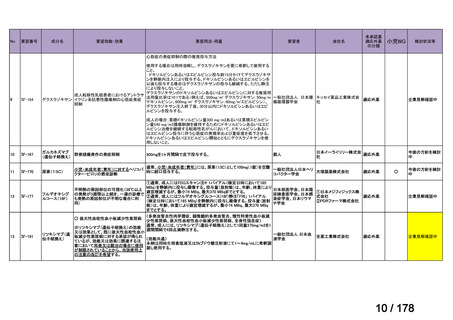
要望された医薬品
要望者名
公益社団法人日本整形外科学会、NPO 法人おれんじの会、個人
一
般
名
トラフェルミン(遺伝子組換え)
会
社
名
科研製薬株式会社、ノーベルファーマ株式会社
効能・効果
要望内容
用法・用量
骨頭圧潰リスクの高い特発性大腿骨頭壊死症の骨頭圧潰の抑制
低侵襲手術(骨穿孔術)により、大腿骨頭内にトラフェルミン(遺伝子組換え)800 μg を含む架橋ゼラチン製剤
を単回投与する。
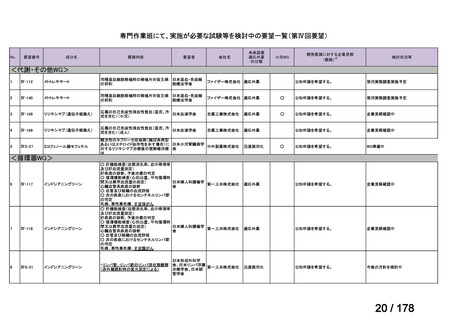
「医療上の必要性に係 (1)適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
イ
特発性大腿骨頭壊死症は、股関節を構成する大腿骨頭が阻血性壊死に陥って圧潰し、股関節機能が失われる難治性疾患である。
大腿骨頭の圧潰の進行は不可逆的であり、股関節機能が失われた場合、患者の QOL は著しく損なわれる。したがって、重篤性は
「イ:病気の進行が不可逆的で、日常生活に著しい影響を及ぼす疾患」に該当すると判断した。
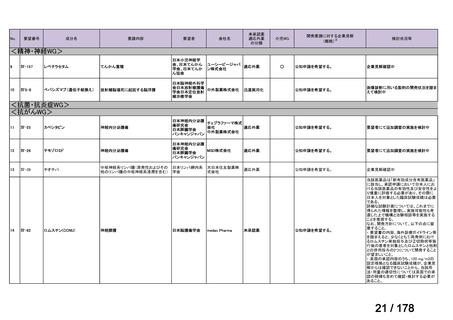
(2)医療上の有用性についての該当性
エ
〔特記事項〕
本要望は、募集対象の分類のうち「優れた試験成績に係る論文が権威のある学術雑誌等で公表されているもの」に該当すると
して要望書が提出された。骨頭圧潰前の特発性大腿骨頭壊死症患者を対象としたトラフェルミン(遺伝子組換え)の架橋ゼラチ
ン製剤(以下、
「本剤」)の多施設共同非盲検非対照第 II 相試験において、主要評価項目とされた投与 24 カ月後の骨頭圧潰割合
[95%信頼区間]は 42.9[30.5, 56.0]%(27/63 例)であり、95%信頼区間の上限は事前に規定した閾値(35%)を下回らなかっ
た(Regen Med 2021; 16: 535-48)
。
本邦において、特発性大腿骨頭壊死症の骨頭圧潰の抑制に係る効能・効果を有する医薬品はないものの、提出された文献は第
II 相試験に係る報告であり、当該試験は検証的な位置付けの試験ではないこと、主要評価項目が事前に設定した閾値を下回らず
試験の主要な目的を達成できなかったことを踏まえると、現時点では本剤の有用性が明確になっているとまでは判断できず、医
療上の必要性の基準には該当しないと判断した。
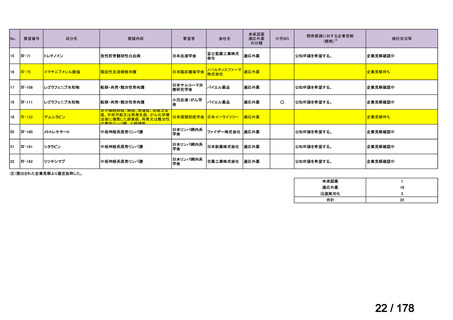
備
考
要望された製剤は「トラフェルミン(遺伝子組換え)800 μgを含む架橋ゼラチン製剤」であるが、既承認のトラフェルミン(遺
伝子組換え)製剤はいずれも外用液剤であり、架橋ゼラチンを基剤とする大腿骨頭内への投与が可能な品質を有するトラフェル
1
24 / 178