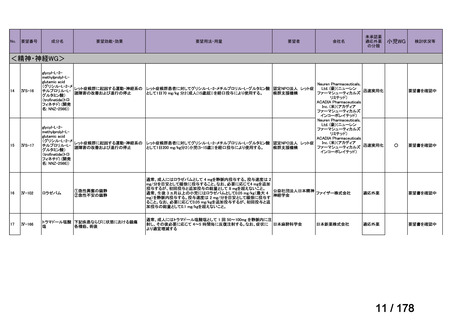
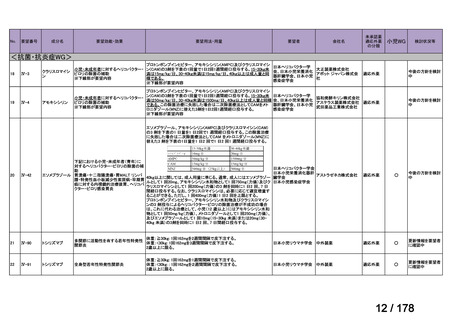
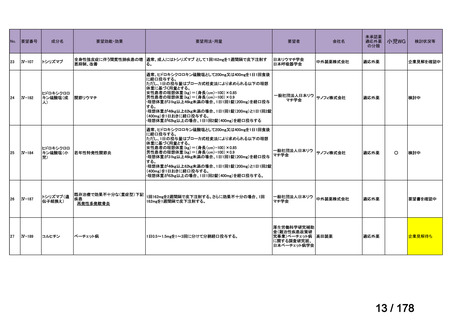
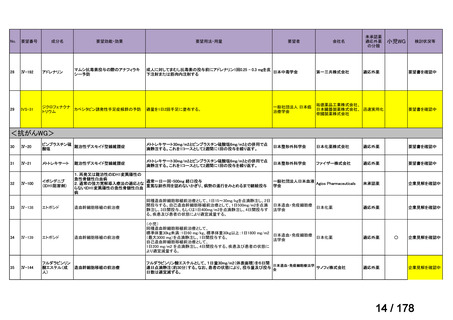
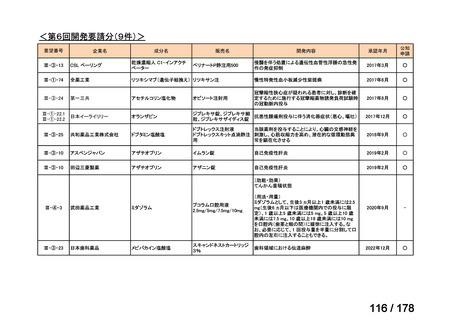
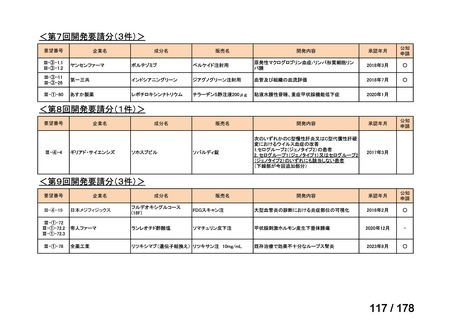
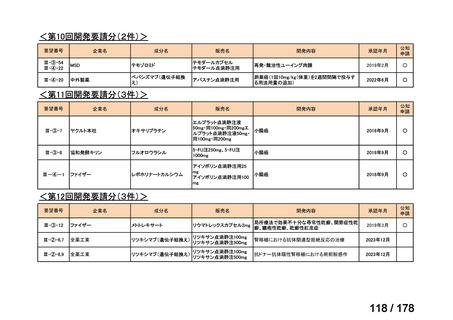
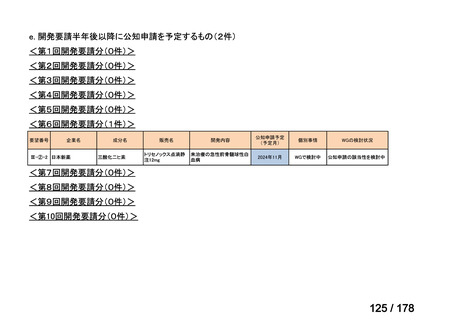
会議資料 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
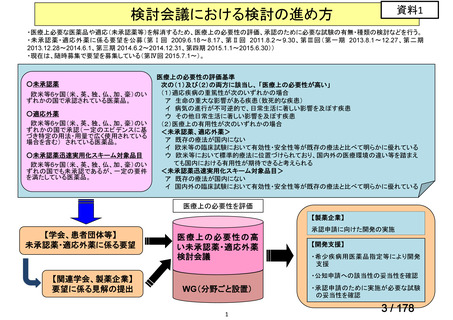
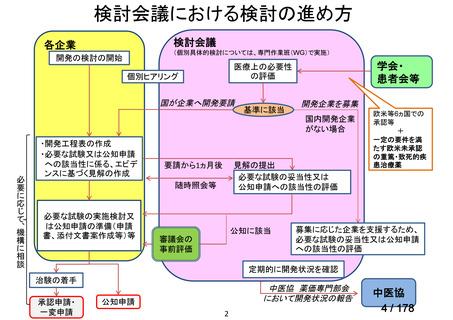
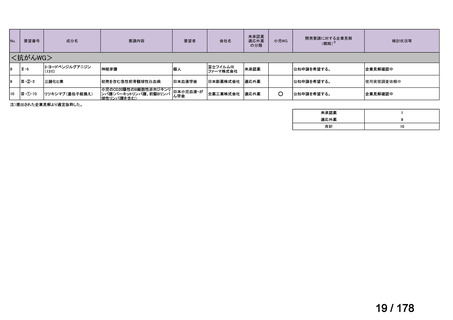
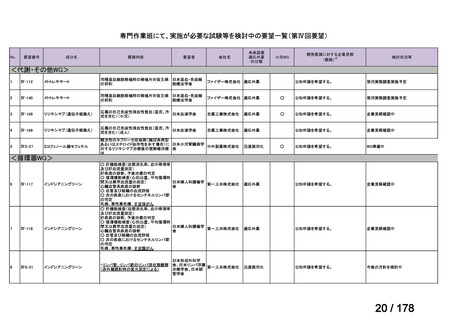
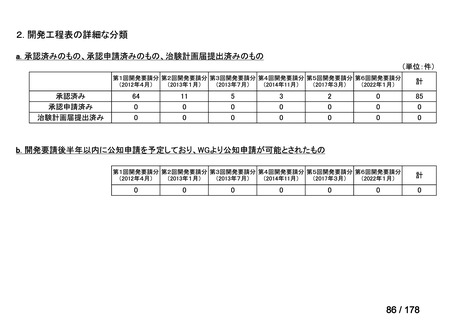
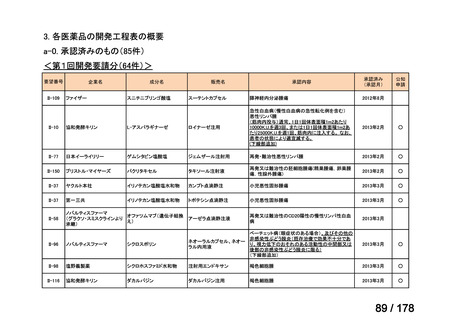
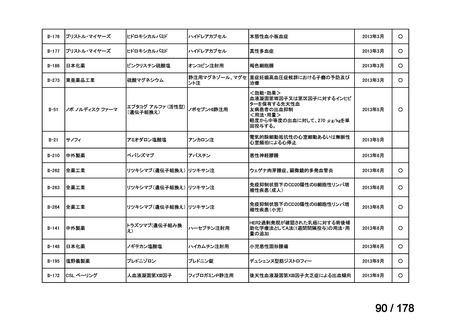
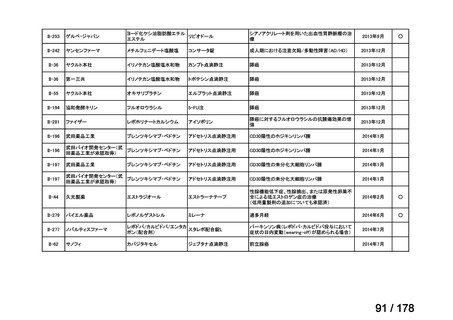
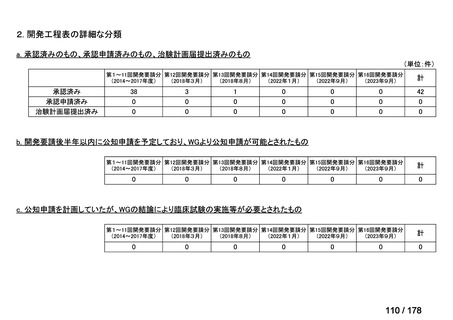
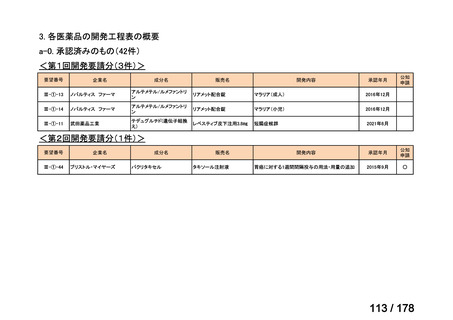
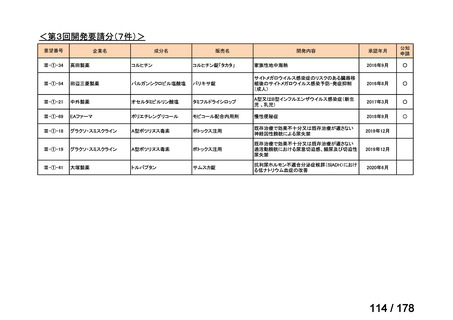
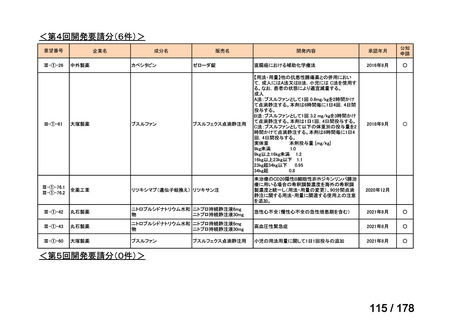
検討会議における検討の進め方
・医療上必要な医薬品や適応(未承認薬等)を解消するため、医療上の必要性の評価、承認のために必要な試験の有無・種類の検討などを行う。
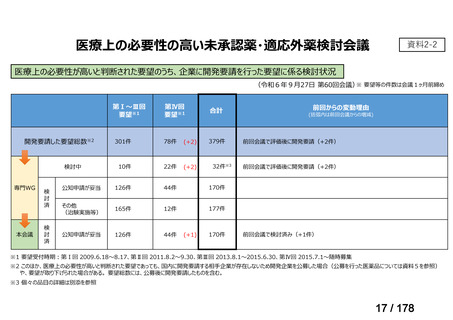
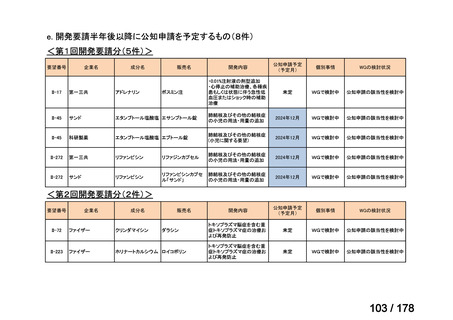
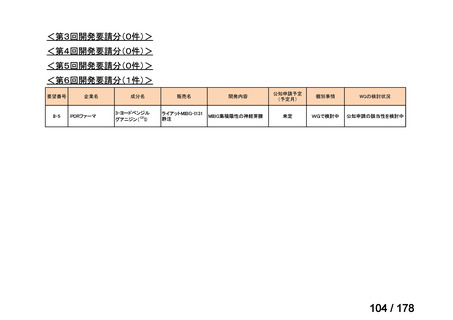
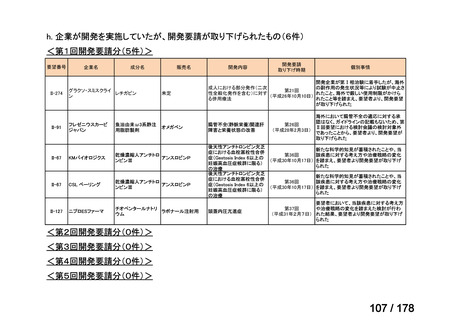
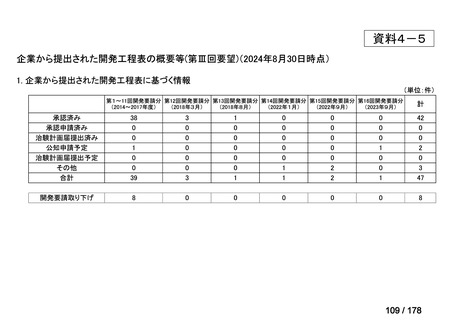
・未承認薬・適応外薬に係る要望を公募(第Ⅰ回 2009.6.18~8.17、第Ⅱ回 2011.8.2~9.30、第Ⅲ回(第一期 2013.8.1~12.27、第二期
2013.12.28~2014.6.1、第三期 2014.6.2~2014.12.31、第四期 2015.1.1~2015.6.30))
・現在は、随時募集で要望を募集している(第Ⅳ回 2015.7.1~)。
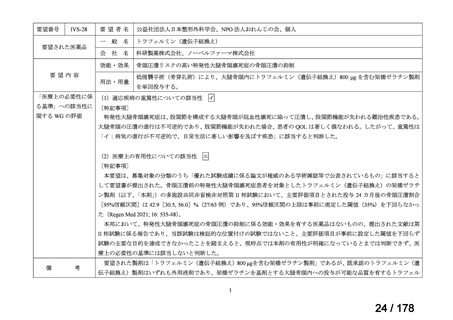
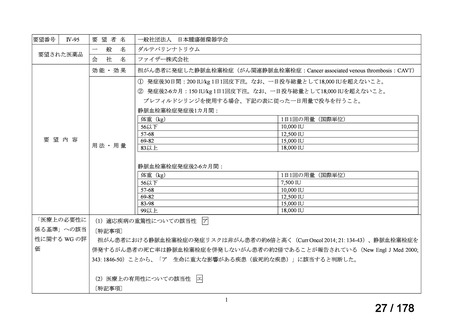
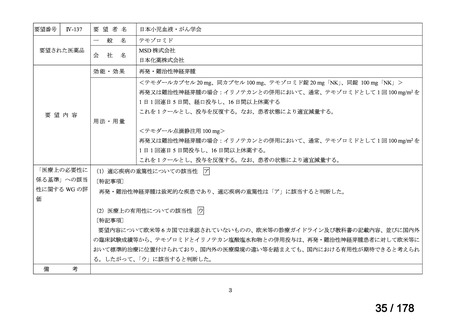
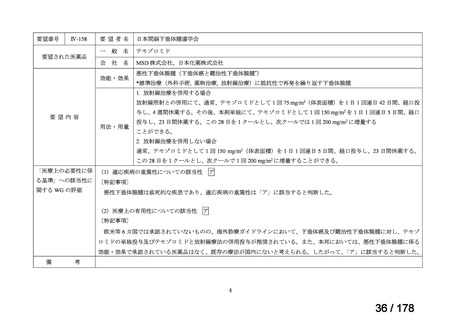
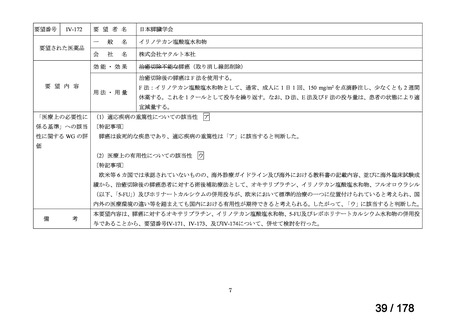
○未承認薬
欧米等6ヶ国(米、英、独、仏、加、豪)のい
ずれかの国で承認されている医薬品。
○適応外薬
欧米等6ヶ国(米、英、独、仏、加、豪)のい
ずれかの国で承認(一定のエビデンスに基
づき特定の用法・用量で広く使用されている
場合を含む) されている医薬品。
○未承認薬迅速実用化スキーム対象品目
欧米等6ヶ国(米、英、独、仏、加、豪)のい
ずれの国でも未承認であるが、一定の要件
を満たしている医薬品。
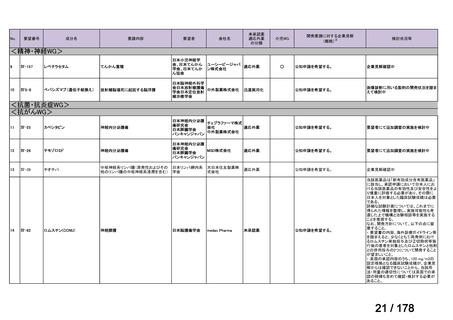
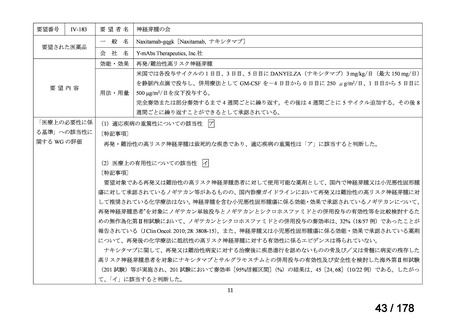
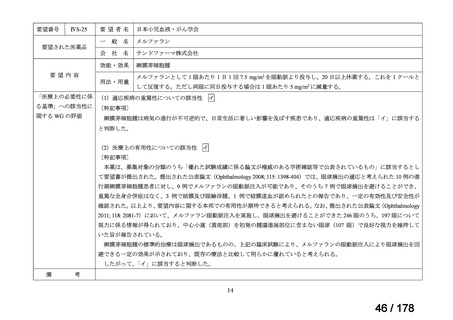
医療上の必要性の評価基準
次の(1)及び(2)の両方に該当し、 「医療上の必要性が高い」
(1)適応疾病の重篤性が次のいずれかの場合
ア 生命の重大な影響がある疾患(致死的な疾患)
イ 病気の進行が不可逆的で、日常生活に著しい影響を及ぼす疾患
ウ その他日常生活に著しい影響を及ぼす疾患
(2)医療上の有用性が次のいずれかの場合
<未承認薬、適応外薬>
ア 既存の療法が国内にない
イ 欧米等の臨床試験において有効性・安全性等が既存の療法と比べて明らかに優れている
ウ 欧米等において標準的療法に位置づけられており、国内外の医療環境の違い等を踏まえ
ても国内における有用性が期待できると考えられる
<未承認薬迅速実用化スキーム対象品目>
ア 既存の療法が国内にない
イ 国内外の臨床試験において有効性・安全性等が既存の療法と比べて明らかに優れている
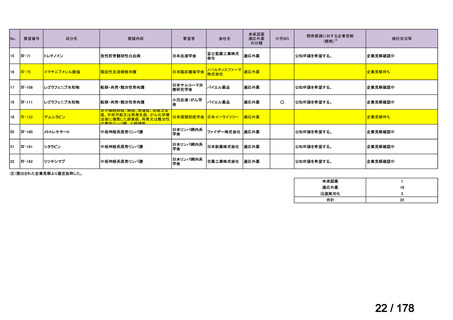
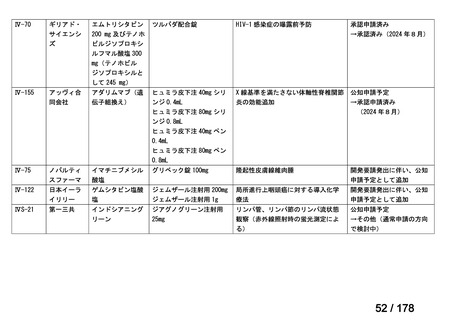
医療上の必要性を評価
【製薬企業】
【学会、患者団体等】
未承認薬・適応外薬に係る要望
【関連学会、製薬企業】
要望に係る見解の提出
承認申請に向けた開発の実施
医 療 上の 必 要性の 高
い未承認薬・適応外薬
検討会議
【開発支援】
・希少疾病用医薬品指定等により開発
支援
・公知申請への該当性の妥当性を確認
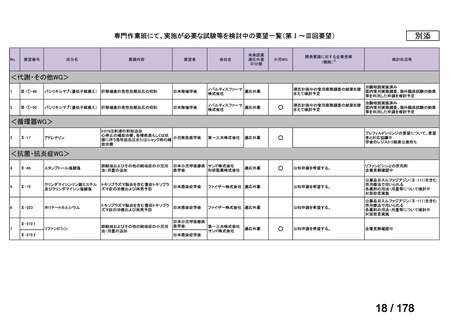
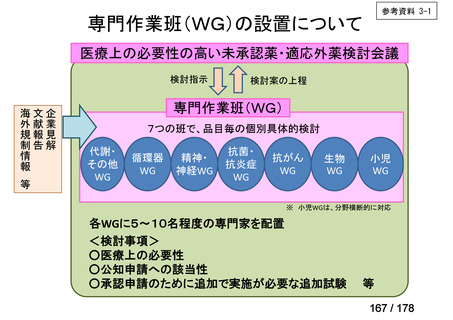
WG(分野ごと設置)
1
・承認申請のために実施が必要な試験
の妥当性を確認
3 / 178