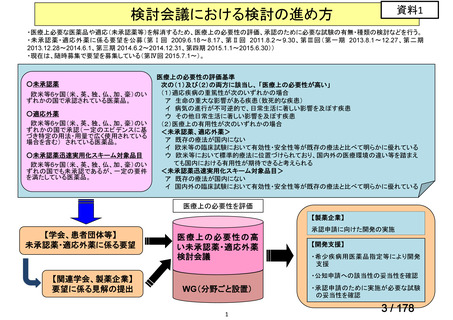
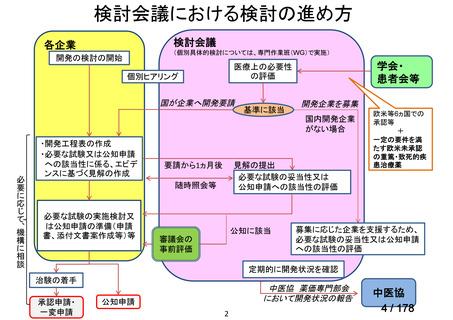
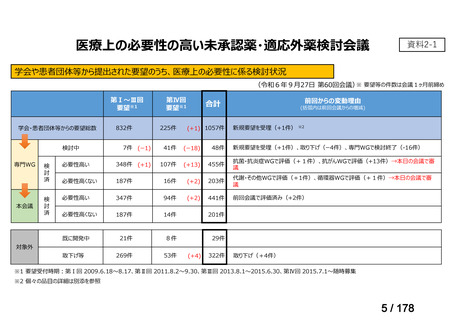
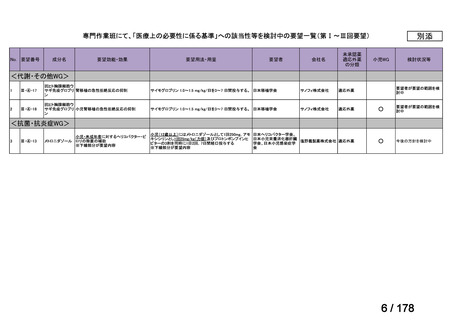
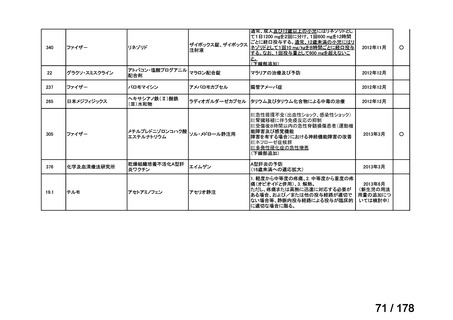
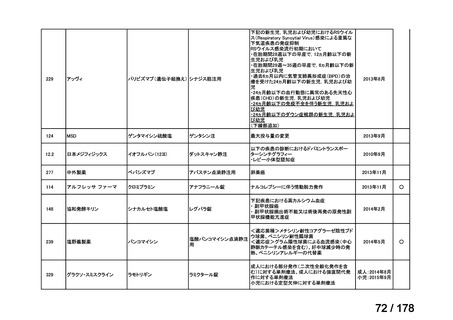
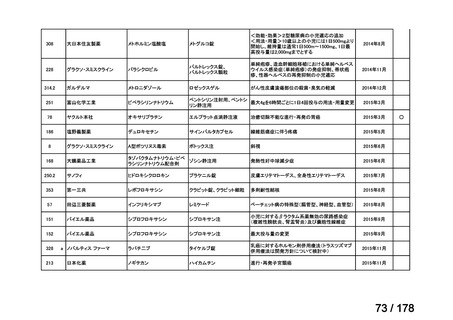
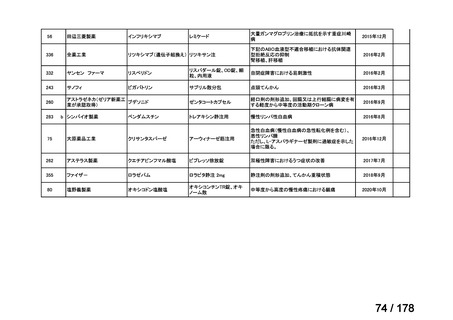
会議資料 (45 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
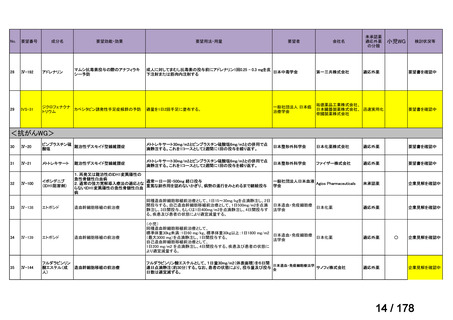
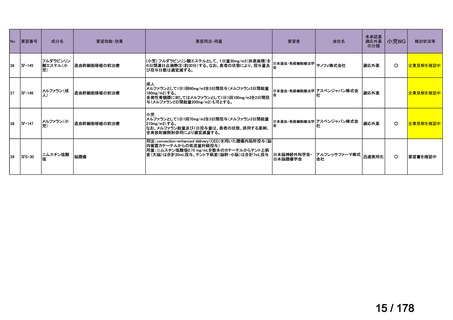
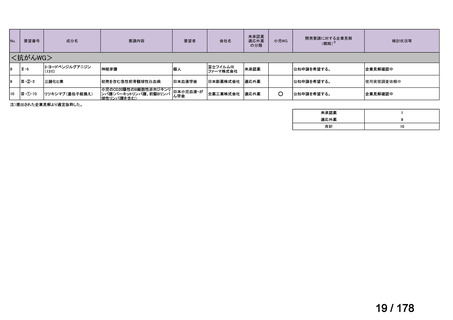
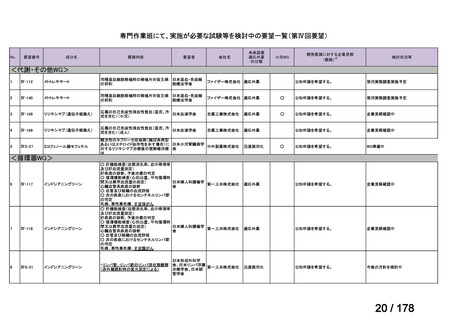
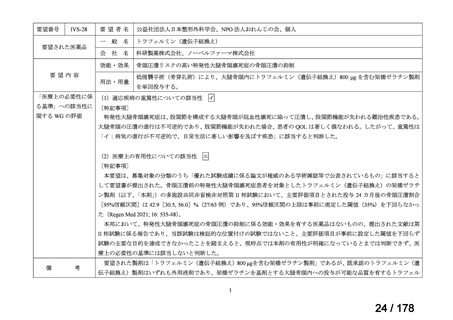
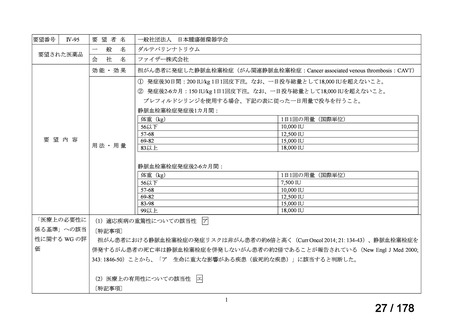
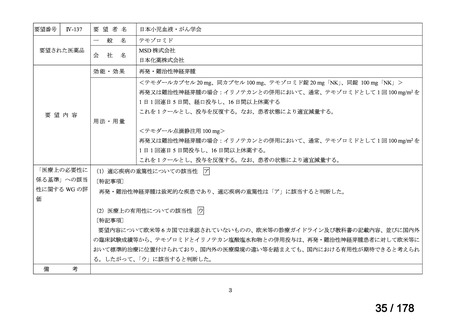
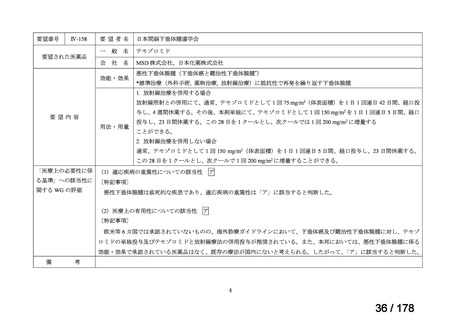
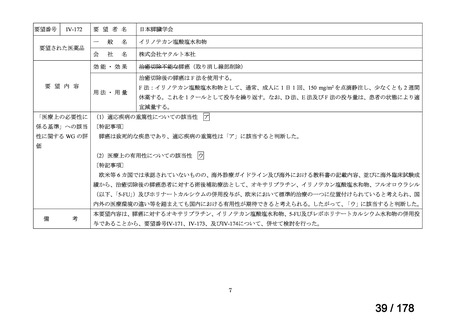
Ⅳ-190
要望された医薬品
要望者名
日本産科婦人科学会、日本婦人科腫瘍学会、日本絨毛性疾患研究会
一
般
名
ペムブロリズマブ(遺伝子組換え)
会
社
名
MSD 株式会社
効能・効果
要望内容
用法・用量
がん化学療法後に増悪した絨毛性腫瘍(絨毛癌*、PSTT、ETT)
*臨床的絨毛癌、high-risk GTN を含む
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1 回 200 mg を 3 週間間隔又は 1 回 400 mg を 6 週
間間隔で 30 分間かけて点滴静注する。
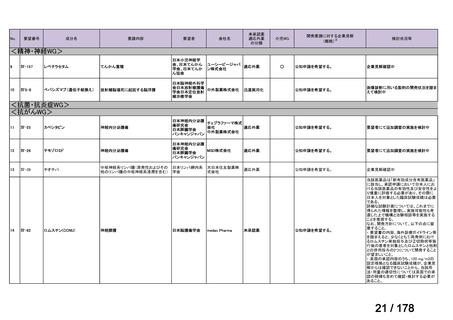
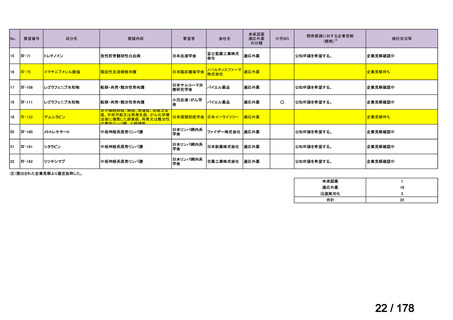
「医療上の必要性に係 (1)適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ア
がん化学療法後に増悪した絨毛性腫瘍は致死的な疾患であり、適応疾病の重篤性は「ア」に該当すると判断した。
(2)医療上の有用性についての該当性
ウ
〔特記事項〕
欧米等 6 カ国では承認されていないものの、海外診療ガイドライン及び海外における教科書の記載内容、並びに海外臨床試験
成績から、ペムブロリズマブ(遺伝子組換え)は、がん化学療法後に増悪した絨毛性腫瘍に対して、欧米等において標準的治療
の一つに位置付けられていると考えられ、国内外の医療環境の違い等を踏まえても国内における有用性が期待できると考えられ
る。したがって、「ウ」に該当すると判断した。
備
考
13
45 / 178