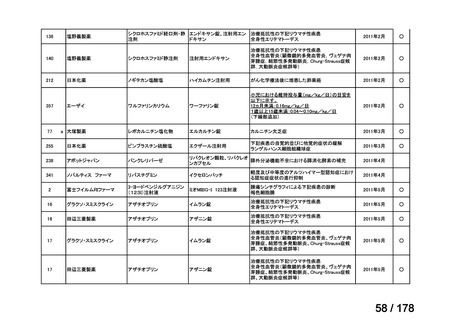
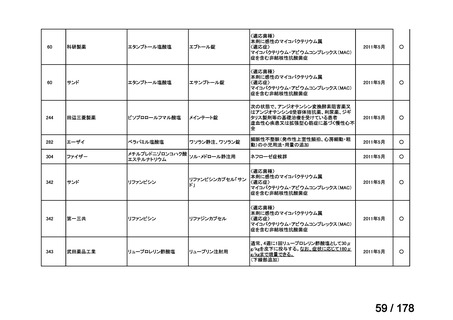
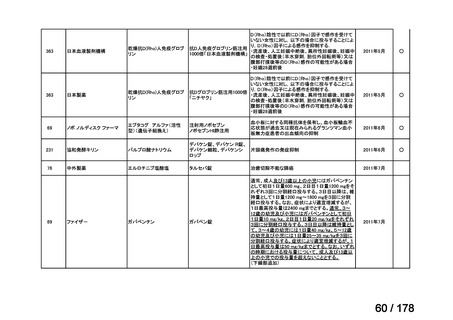
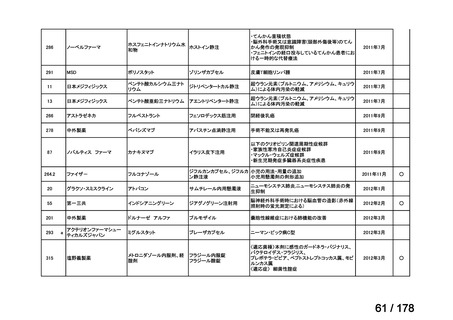
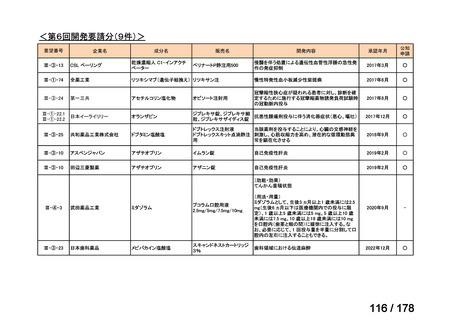
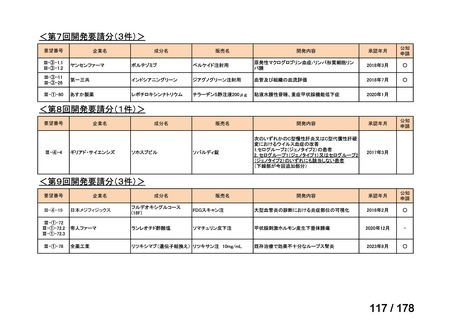
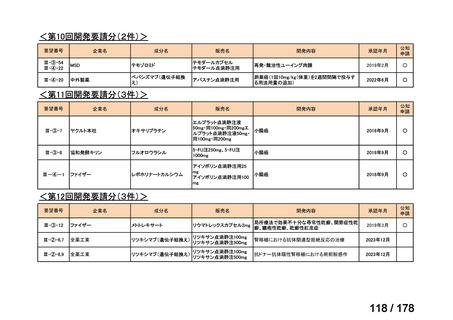
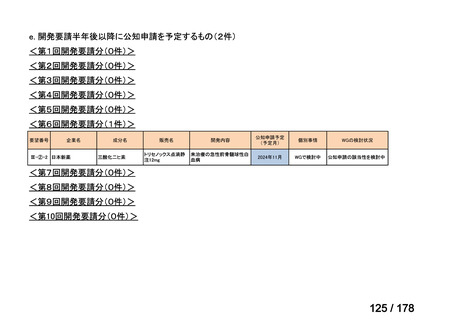
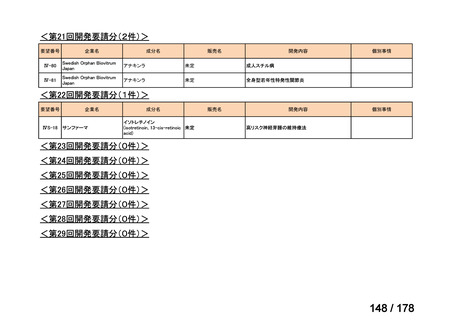
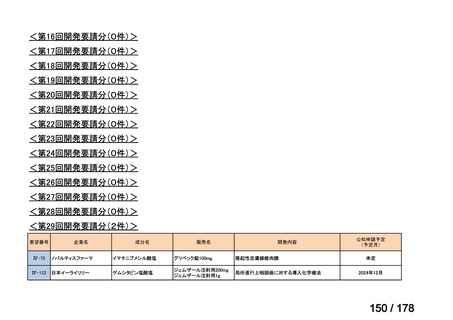
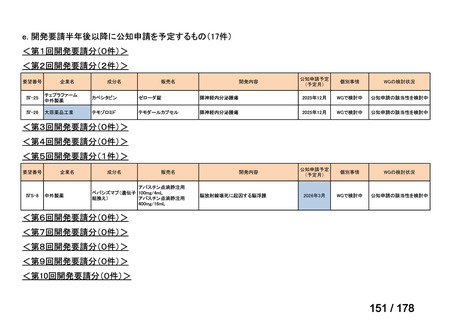
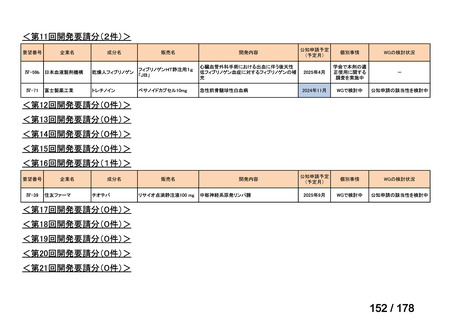
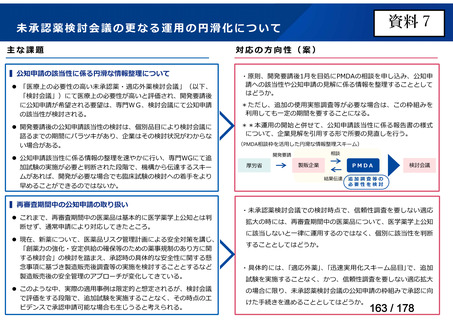
会議資料 (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00034.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第60回 9/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
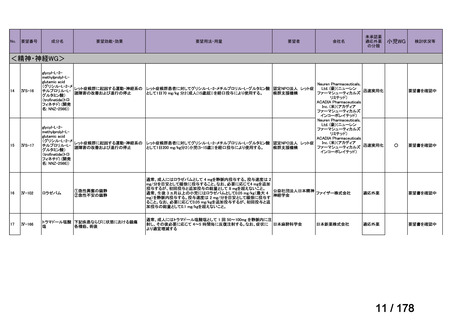
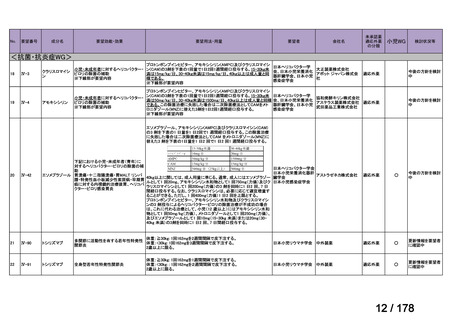
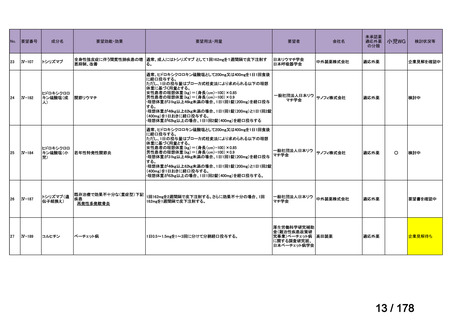
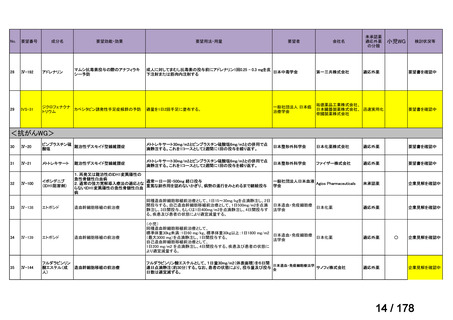
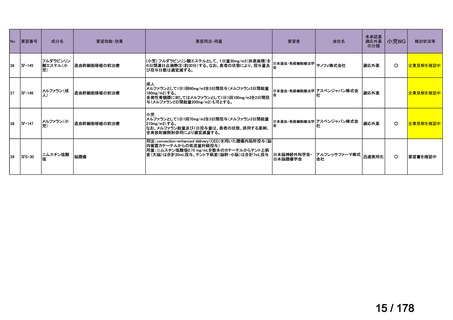
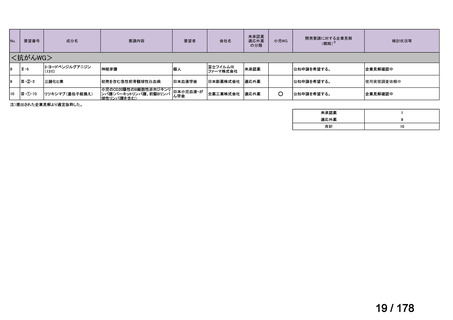
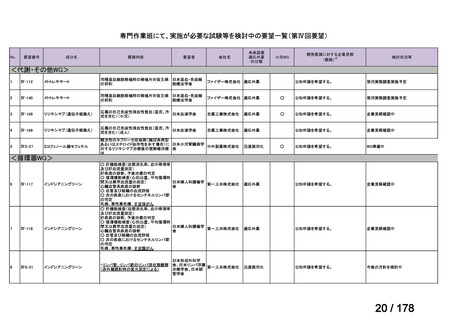
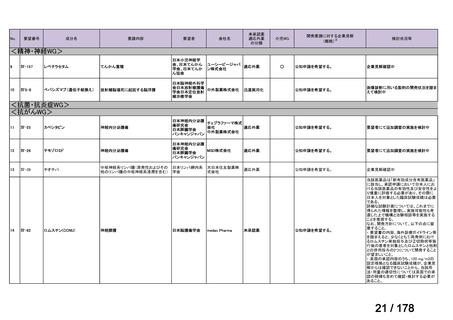
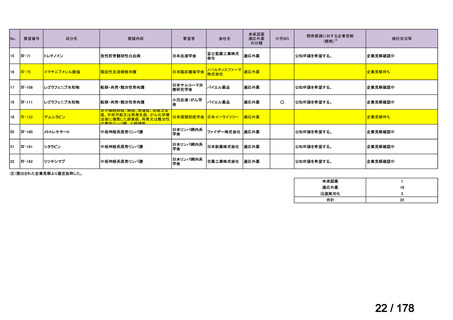
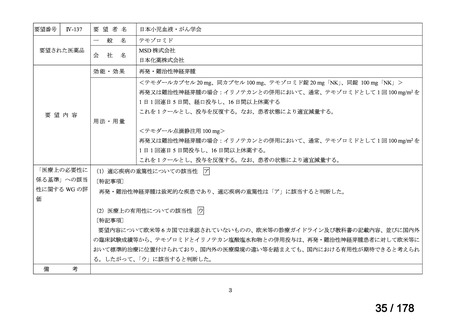
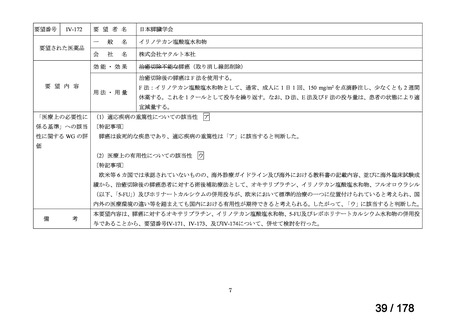
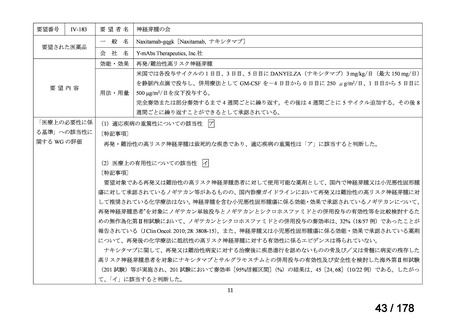
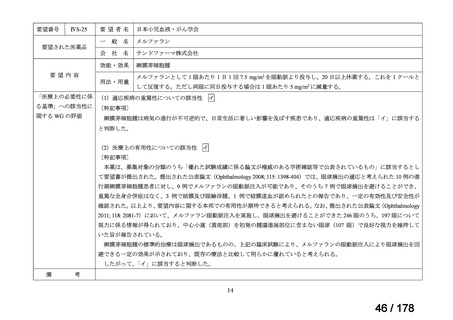
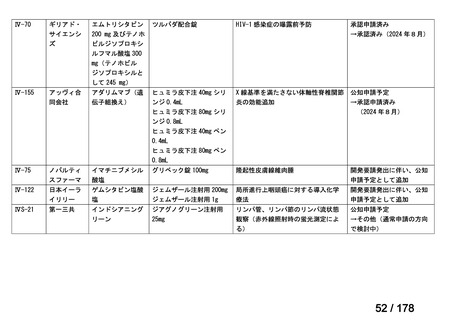
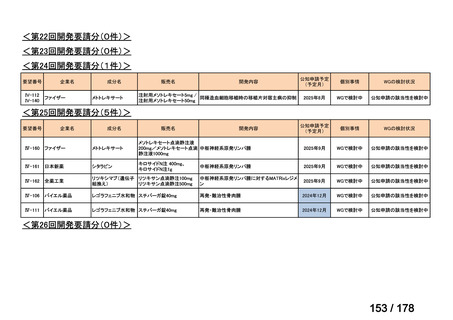
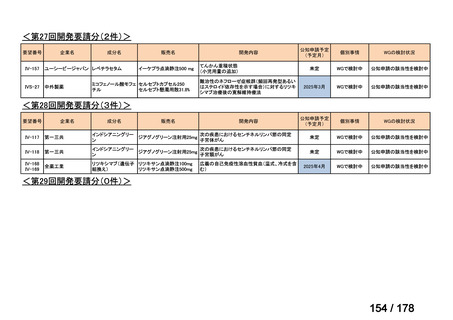
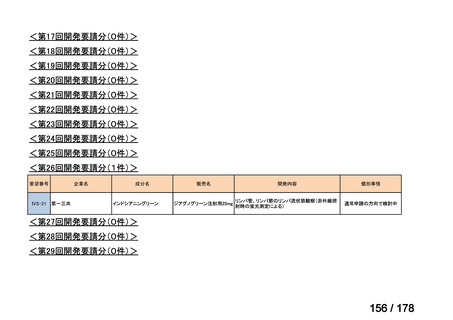
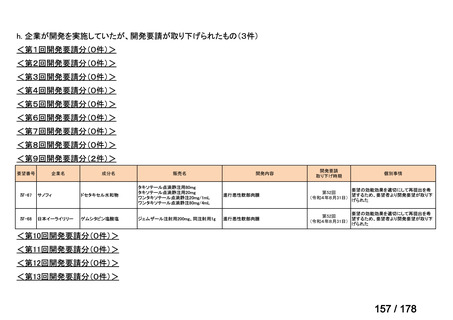
Ⅳ-137
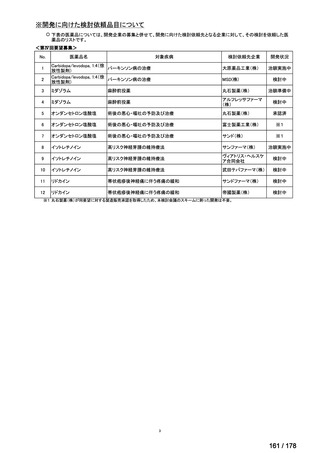
要望された医薬品
要 望 者 名
日本小児血液・がん学会
一
般
名
テモゾロミド
会
社
名
効能・効果
MSD 株式会社
日本化薬株式会社
再発・難治性神経芽腫
<テモダールカプセル 20 mg、同カプセル 100 mg、テモゾロミド錠 20 mg「NK」
、同錠 100 mg「NK」>
再発又は難治性神経芽腫の場合:イリノテカンとの併用において、通常、テモゾロミドとして 1 回 100 mg/m2 を
1 日 1 回連日 5 日間、経口投与し、16 日間以上休薬する
これを 1 クールとし、投与を反復する。なお、患者状態により適宜減量する。
要 望 内 容
用法・用量
<テモダール点滴静注用 100 mg>
再発又は難治性神経芽腫の場合:イリノテカンとの併用において、通常、テモゾロミドとして 1 回 100 mg/m2 を
1 日 1 回連日 5 日間投与し、16 日間以上休薬する。
これを 1 クールとし、投与を反復する。なお、患者の状態により適宜減量する。
「医療上の必要性に (1)適応疾病の重篤性についての該当性
係る基準」への該当 〔特記事項〕
性に関する WG の評
ア
再発・難治性神経芽腫は致死的な疾患であり、適応疾病の重篤性は「ア」に該当すると判断した。
価
(2)医療上の有用性についての該当性
ウ
〔特記事項〕
要望内容について欧米等 6 カ国では承認されていないものの、欧米等の診療ガイドライン及び教科書の記載内容、並びに国内外
の臨床試験成績等から、テモゾロミドとイリノテカン塩酸塩水和物との併用投与は、再発・難治性神経芽腫患者に対して欧米等に
おいて標準的治療に位置付けられており、国内外の医療環境の違い等を踏まえても、国内における有用性が期待できると考えられ
る。したがって、「ウ」に該当すると判断した。
備
考
3
35 / 178