よむ、つかう、まなぶ。
資料2-2 MID-NET・NDB の行政利活用の調査実施状況について[3.8MB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和6年 10 月 24 日
令和6年度2回
医薬品等安全対策部会
MID-NET・NDB の行政利活用の調査実施状況について
(令和6年6月 20 日~令和6年 10 月 24 日調査結果公表分)*
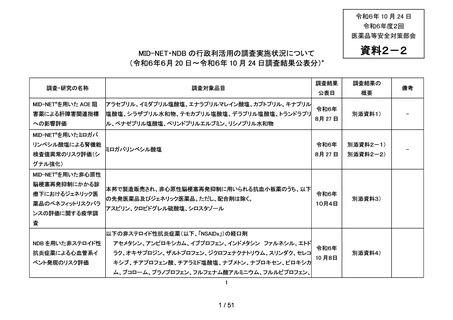
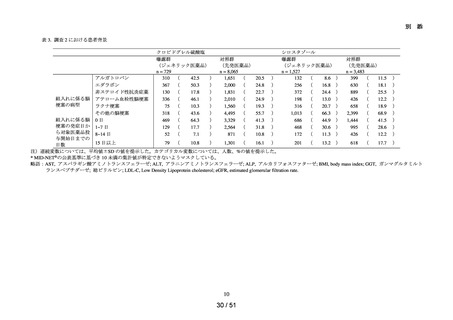
調査・研究の名称
調査対象品目
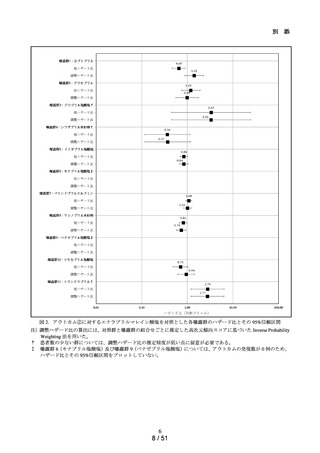
MID-NET®を用いた ACE 阻
アラセプリル、イミダプリル塩酸塩、エナラプリルマレイン酸塩、カプトプリル、キナプリル
害薬による肝障害関連指標
塩酸塩、シラザプリル水和物、テモカプリル塩酸塩、デラプリル塩酸塩、トランドラプリ
への影響評価
ル、ベナゼプリル塩酸塩、ペリンドプリルエルブミン、リシノプリル水和物
資料2-2
調査結果
調査結果の
公表日
概要
令和6年
8月 27 日
別添資料1)
備考
-
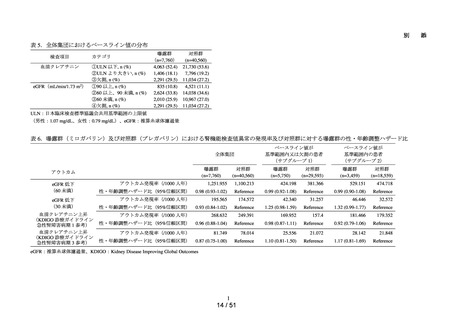
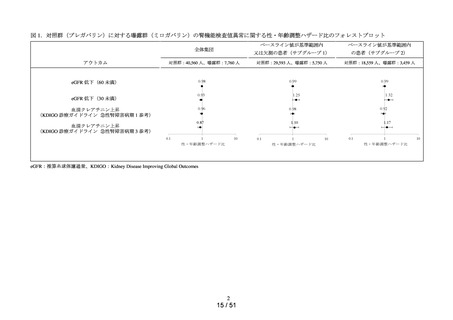
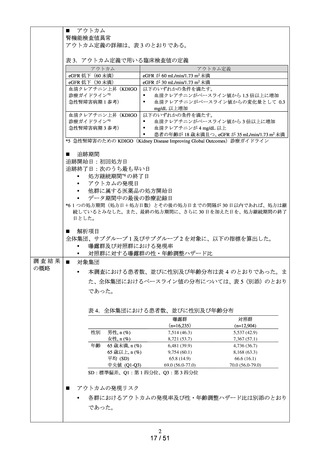
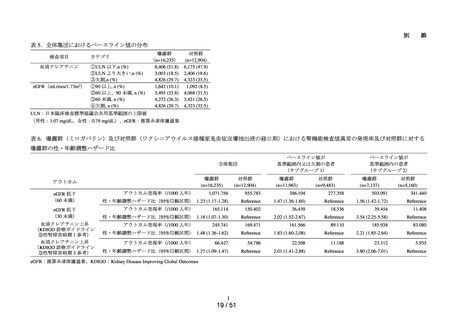
MID-NET®を用いたミロガバ
リンベシル酸塩による腎機能
検査値異常のリスク評価(シ
ミロガバリンベシル酸塩
令和6年
別添資料2-1)
8月 27 日
別添資料2-2)
グナル強化)
MID-NET®を用いた非心原性
脳梗塞再発抑制にかかる診
療下におけるジェネリック医
薬品のベネフィットリスクバラ
ンスの評価に関する疫学調
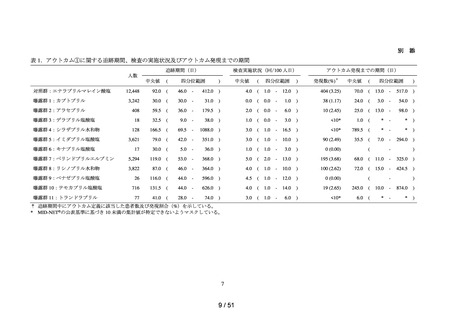
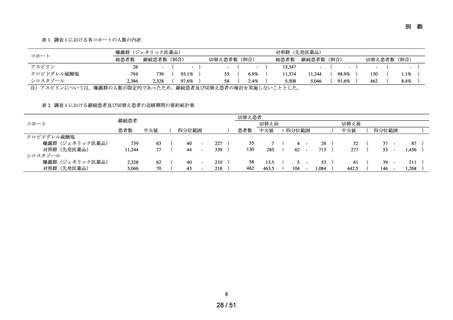
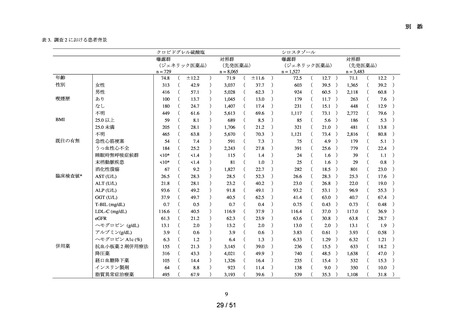
本邦で製造販売され、非心原性脳梗塞再発抑制に用いられる抗血小板薬のうち、以下
の先発医薬品及びジェネリック医薬品。ただし、配合剤は除く。
アスピリン、クロピドグレル硫酸塩、シロスタゾール
令和6年
10月4日
別添資料3)
査
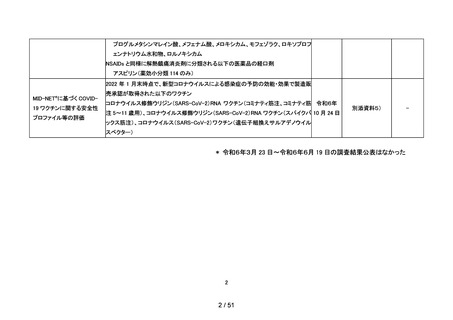
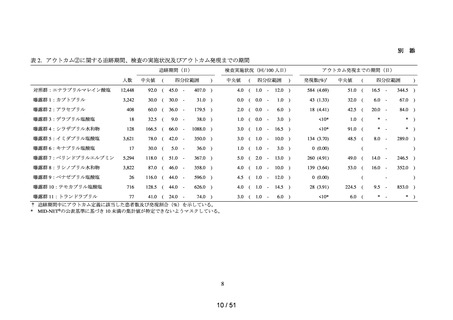
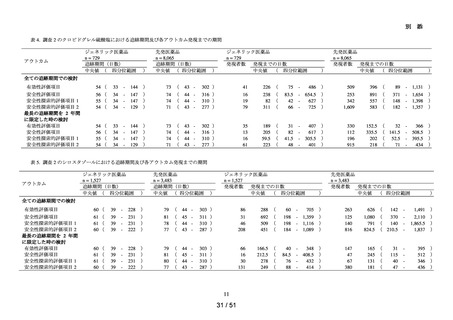
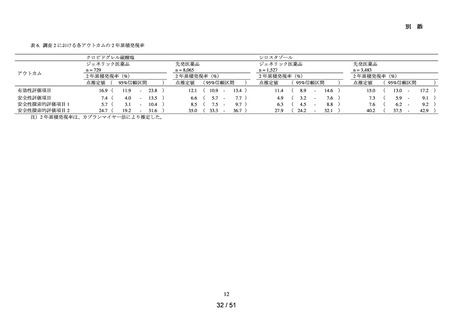
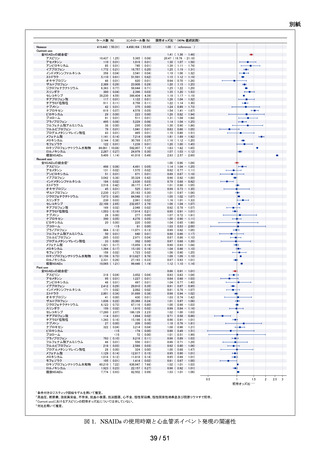
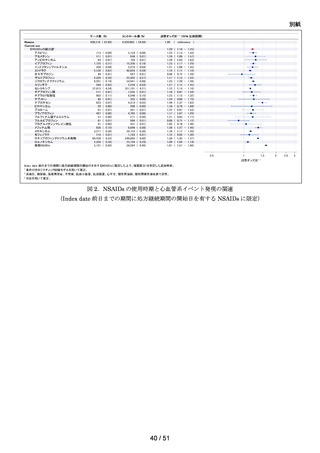
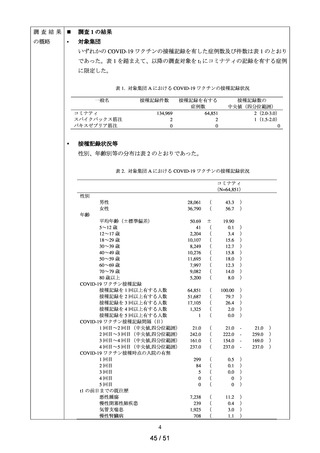
以下の非ステロイド性抗炎症薬(以下、「NSAIDs」)の経口剤
NDB を用いた非ステロイド性
アセメタシン、アンピロキシカム、イブプロフェン、インドメタシン ファルネシル、エトド
抗炎症薬による心血管系イ
ラク、オキサプロジン、ザルトプロフェン、ジクロフェナクナトリウム、スリンダク、セレコ
ベント発現のリスク評価
キシブ、チアプロフェン酸、チアラミド塩酸塩、ナブメトン、ナプロキセン、ピロキシカ
ム、ブコローム、プラノプロフェン、フルフェナム酸アルミニウム、フルルビプロフェン、
1
1 / 51
令和6年
10 月8日
別添資料4)
-
令和6年度2回
医薬品等安全対策部会
MID-NET・NDB の行政利活用の調査実施状況について
(令和6年6月 20 日~令和6年 10 月 24 日調査結果公表分)*
調査・研究の名称
調査対象品目
MID-NET®を用いた ACE 阻
アラセプリル、イミダプリル塩酸塩、エナラプリルマレイン酸塩、カプトプリル、キナプリル
害薬による肝障害関連指標
塩酸塩、シラザプリル水和物、テモカプリル塩酸塩、デラプリル塩酸塩、トランドラプリ
への影響評価
ル、ベナゼプリル塩酸塩、ペリンドプリルエルブミン、リシノプリル水和物
資料2-2
調査結果
調査結果の
公表日
概要
令和6年
8月 27 日
別添資料1)
備考
-
MID-NET®を用いたミロガバ
リンベシル酸塩による腎機能
検査値異常のリスク評価(シ
ミロガバリンベシル酸塩
令和6年
別添資料2-1)
8月 27 日
別添資料2-2)
グナル強化)
MID-NET®を用いた非心原性
脳梗塞再発抑制にかかる診
療下におけるジェネリック医
薬品のベネフィットリスクバラ
ンスの評価に関する疫学調
本邦で製造販売され、非心原性脳梗塞再発抑制に用いられる抗血小板薬のうち、以下
の先発医薬品及びジェネリック医薬品。ただし、配合剤は除く。
アスピリン、クロピドグレル硫酸塩、シロスタゾール
令和6年
10月4日
別添資料3)
査
以下の非ステロイド性抗炎症薬(以下、「NSAIDs」)の経口剤
NDB を用いた非ステロイド性
アセメタシン、アンピロキシカム、イブプロフェン、インドメタシン ファルネシル、エトド
抗炎症薬による心血管系イ
ラク、オキサプロジン、ザルトプロフェン、ジクロフェナクナトリウム、スリンダク、セレコ
ベント発現のリスク評価
キシブ、チアプロフェン酸、チアラミド塩酸塩、ナブメトン、ナプロキセン、ピロキシカ
ム、ブコローム、プラノプロフェン、フルフェナム酸アルミニウム、フルルビプロフェン、
1
1 / 51
令和6年
10 月8日
別添資料4)
-