よむ、つかう、まなぶ。
資料2-2 MID-NET・NDB の行政利活用の調査実施状況について[3.8MB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
処方時点とは異なる成分の ACE 阻害薬の処方開始日又は③データ期間中の最後の
医療記録日のいずれか早い日までの期間。
肝機能検査値異常の定義:
<アウトカム①>
以下の a)又は b)を満たし、その記録日の前 90 日間に全ての肝機能検査値がグレー
ド 1†以下であること。
a)
グレード 2†以上の AST 及び ALT が同日に記録されていること。
b)
グレード 2†以上の ALP 及び T-BIL が同日に記録されていること。
なお、追跡期間中に当該定義を初めて満たした日をアウトカム①の発現日とする。
<アウトカム②>
いずれかの肝機能検査値(AST、ALT、ALP 又は T-BIL)がグレード 3‡以上である
こと。
なお、追跡期間中に当該定義を初めて満たした日をアウトカム②の発現日とする。
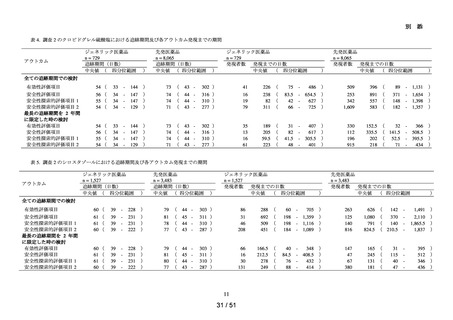
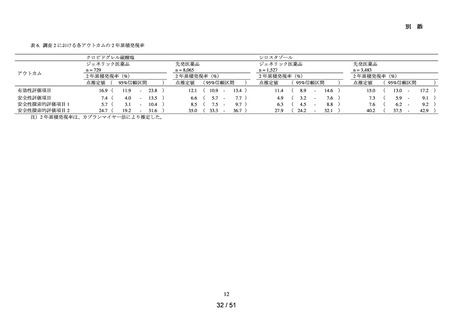
解析項目及び方法:
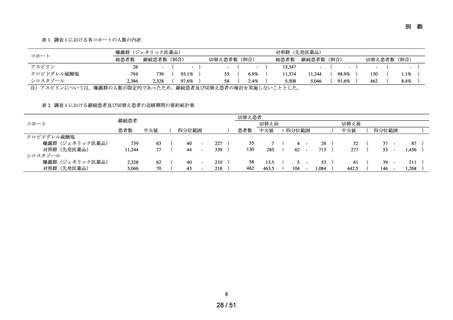
➢
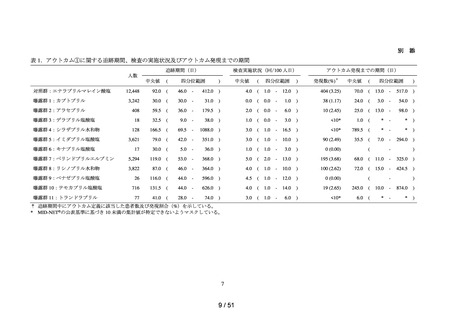
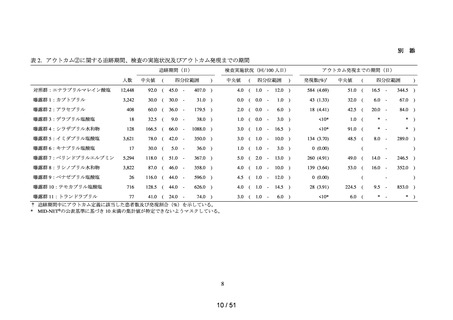
各群において、患者数並びに追跡期間の中央値及び四分位範囲を集計した。ま
た、追跡期間中の検査の実施状況§について、100 人日あたりの実施回数の中央
値及び四分位範囲を集計した。
➢
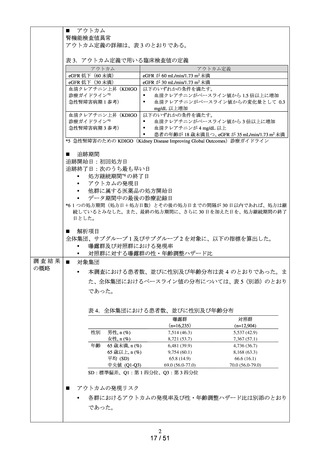
アウトカムの発現状況については、各群における追跡期間中にアウトカム定義
に該当した患者数及びその割合を算出した。また、アウトカム発現までの期間
について、群ごとに中央値及び四分位範囲を算出した。
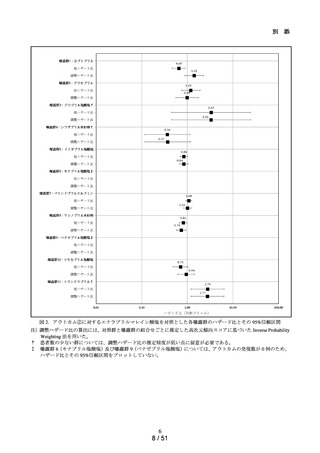
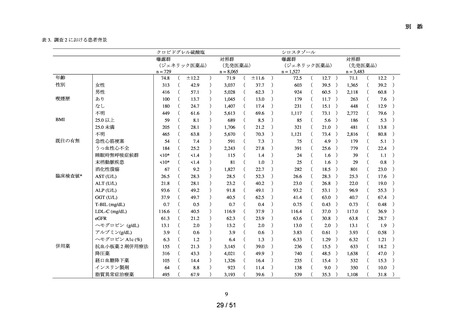
➢
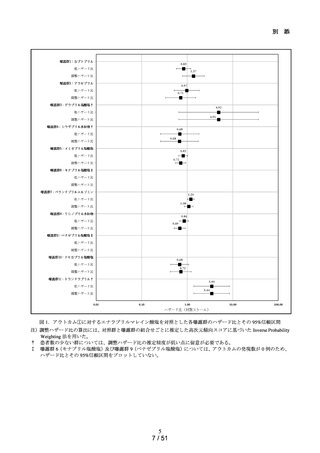
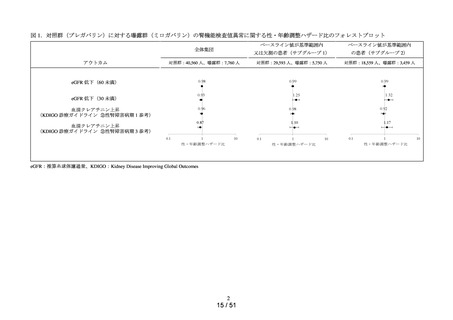
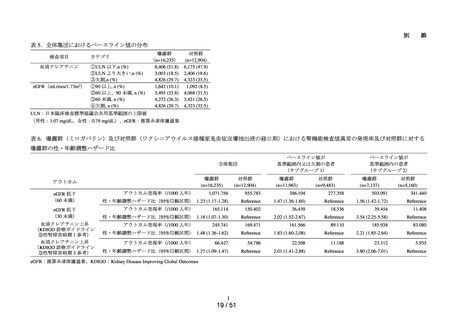
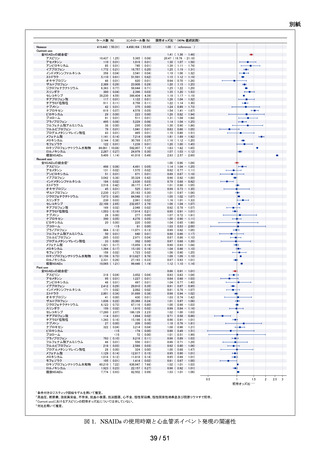
肝機能検査値異常の発現リスクについて、対照群であるエナラプリルマレイン
酸塩と各曝露群を比較するために、Cox 比例ハザードモデルを用い、アウトカ
ム①及びアウトカム②に関する粗ハザード比及び調整ハザード比並びにそれ
らの 95%信頼区間を推定した。調整ハザード比を推定する際に、対照群と曝露
群の組合せごとに推定した高次元傾向スコアに基づいた Inverse Probability
Weighting を用いた。なお、性別、年齢(65 歳以上か否か)、肝機能検査値異
常の既往歴†、糖尿病治療薬の処方の有無、脂質異常症治療薬の処方の有無及
び心不全の並存を、基本的な共変量として、高次元傾向スコアを推定するモデ
ルに含めた。また、対照群と曝露群の組合せごとに、群間で高次元傾向スコア
が重なっている集団に限定した解析についても、実施した。各医薬品で効能又
は効果に差異があるため(エナラプリルマレイン酸塩及びリシノプリル水和物
は心不全に関する効能又は効果を有する等)、心不全を有さず、高血圧症の病
名を有する患者に限定した集団においても同様の解析を感度解析として実施
した。
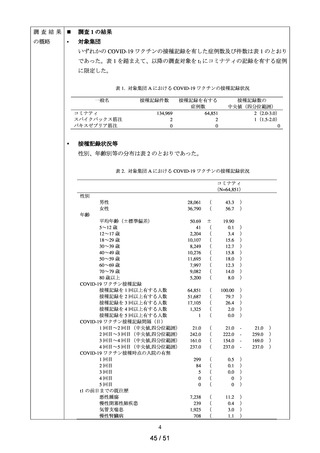
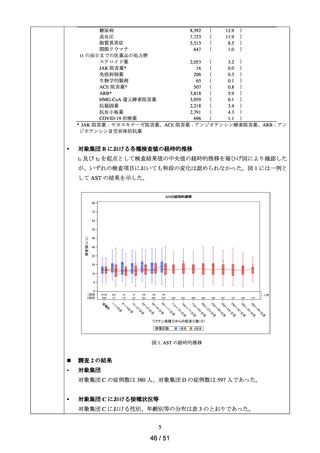
調査結果
◼
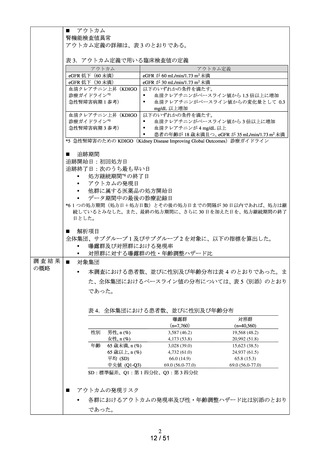
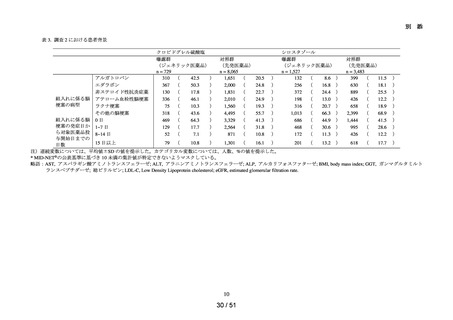
対象集団
の概略
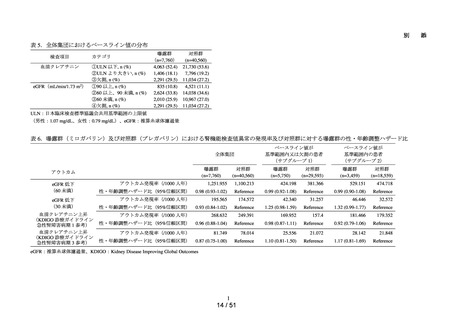
データ期間中に ACE 阻害薬の新規処方を有する患者数**は 34,070 人であり、その
‡
有害事象共通用語規準(Common Terminology Criteria for Adverse Events)v5.0 日本語訳 日本臨床腫瘍研究グループ版
を基準に設定した。
§ 検査の実施は、アウトカムを判断可能な検査を実施していたか否かで判断した。アウトカム①の評価においては、
AST 及び ALT が同日に測定されていること又は ALP 及び T-BIL が同日に測定されていることをもって実施と判断し
た。アウトカム②の評価においては、AST、ALT、ALP 又は T-BIL が測定されていることをもって実施と判断した。
** 新規処方時点で、複数の ACE 阻害薬の医薬品が処方されている患者については対象集団から除外している。
2
4 / 51
医療記録日のいずれか早い日までの期間。
肝機能検査値異常の定義:
<アウトカム①>
以下の a)又は b)を満たし、その記録日の前 90 日間に全ての肝機能検査値がグレー
ド 1†以下であること。
a)
グレード 2†以上の AST 及び ALT が同日に記録されていること。
b)
グレード 2†以上の ALP 及び T-BIL が同日に記録されていること。
なお、追跡期間中に当該定義を初めて満たした日をアウトカム①の発現日とする。
<アウトカム②>
いずれかの肝機能検査値(AST、ALT、ALP 又は T-BIL)がグレード 3‡以上である
こと。
なお、追跡期間中に当該定義を初めて満たした日をアウトカム②の発現日とする。
解析項目及び方法:
➢
各群において、患者数並びに追跡期間の中央値及び四分位範囲を集計した。ま
た、追跡期間中の検査の実施状況§について、100 人日あたりの実施回数の中央
値及び四分位範囲を集計した。
➢
アウトカムの発現状況については、各群における追跡期間中にアウトカム定義
に該当した患者数及びその割合を算出した。また、アウトカム発現までの期間
について、群ごとに中央値及び四分位範囲を算出した。
➢
肝機能検査値異常の発現リスクについて、対照群であるエナラプリルマレイン
酸塩と各曝露群を比較するために、Cox 比例ハザードモデルを用い、アウトカ
ム①及びアウトカム②に関する粗ハザード比及び調整ハザード比並びにそれ
らの 95%信頼区間を推定した。調整ハザード比を推定する際に、対照群と曝露
群の組合せごとに推定した高次元傾向スコアに基づいた Inverse Probability
Weighting を用いた。なお、性別、年齢(65 歳以上か否か)、肝機能検査値異
常の既往歴†、糖尿病治療薬の処方の有無、脂質異常症治療薬の処方の有無及
び心不全の並存を、基本的な共変量として、高次元傾向スコアを推定するモデ
ルに含めた。また、対照群と曝露群の組合せごとに、群間で高次元傾向スコア
が重なっている集団に限定した解析についても、実施した。各医薬品で効能又
は効果に差異があるため(エナラプリルマレイン酸塩及びリシノプリル水和物
は心不全に関する効能又は効果を有する等)、心不全を有さず、高血圧症の病
名を有する患者に限定した集団においても同様の解析を感度解析として実施
した。
調査結果
◼
対象集団
の概略
データ期間中に ACE 阻害薬の新規処方を有する患者数**は 34,070 人であり、その
‡
有害事象共通用語規準(Common Terminology Criteria for Adverse Events)v5.0 日本語訳 日本臨床腫瘍研究グループ版
を基準に設定した。
§ 検査の実施は、アウトカムを判断可能な検査を実施していたか否かで判断した。アウトカム①の評価においては、
AST 及び ALT が同日に測定されていること又は ALP 及び T-BIL が同日に測定されていることをもって実施と判断し
た。アウトカム②の評価においては、AST、ALT、ALP 又は T-BIL が測定されていることをもって実施と判断した。
** 新規処方時点で、複数の ACE 阻害薬の医薬品が処方されている患者については対象集団から除外している。
2
4 / 51