よむ、つかう、まなぶ。
資料2-2 MID-NET・NDB の行政利活用の調査実施状況について[3.8MB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添資料1
MID-NET を用いた調査結果の概要
®
2024 年 8 月 27 日
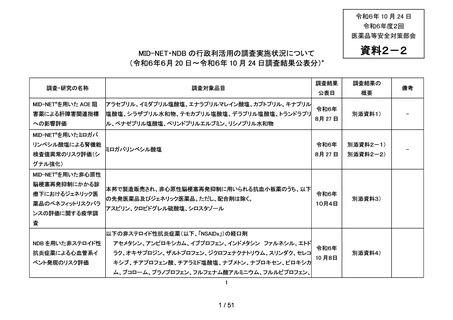
調査・研究 MID-NET®を用いた ACE 阻害薬による肝障害関連指標への影響評価
の名称
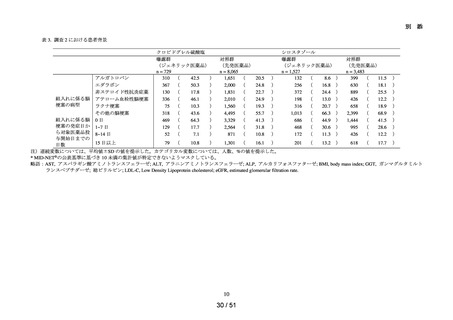
調査対象
アラセプリル、イミダプリル塩酸塩、エナラプリルマレイン酸塩、カプトプリル、キナ
品目
プリル塩酸塩、シラザプリル水和物、テモカプリル塩酸塩、デラプリル塩酸塩、トラン
ドラプリル、ベナゼプリル塩酸塩、ペリンドプリルエルブミン、リシノプリル水和物
調査背景
◼
アンジオテンシン変換酵素阻害薬(以下、「ACE 阻害薬」)は、高血圧症に対して
広く使用されている医薬品であり、臨床試験等の結果を踏まえて、注意事項等情報
の「その他の副作用」の項にて、肝機能障害の関連事象について注意喚起がされて
いる。
◼
一方で、「重大な副作用」の項での注意喚起の状況は、医薬品によって異なってい
る(注意喚起がされている医薬品は、エナラプリルマレイン酸塩、テモカプリル塩
酸塩、トランドラプリル、ベナゼプリル塩酸塩及びリシノプリル水和物である)。
調査目的
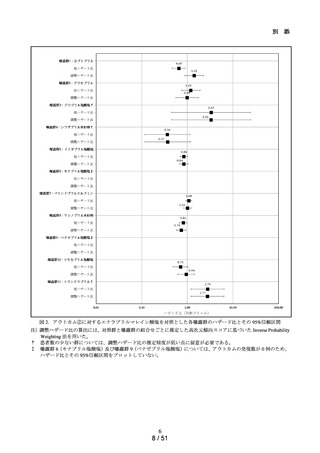
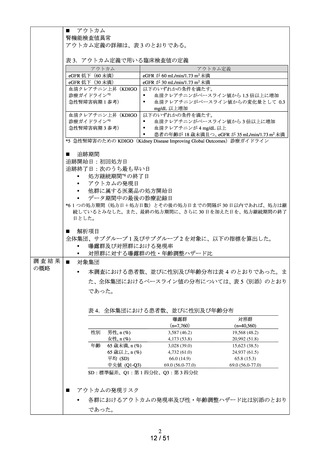
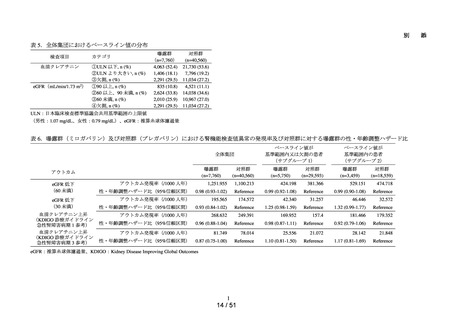
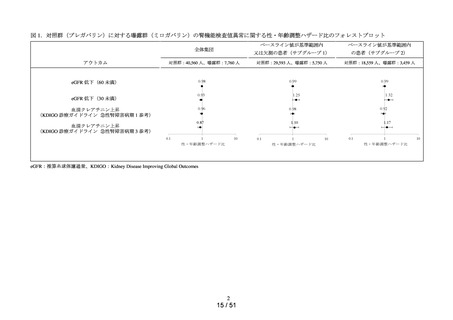
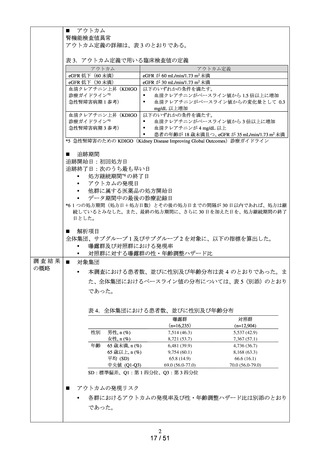
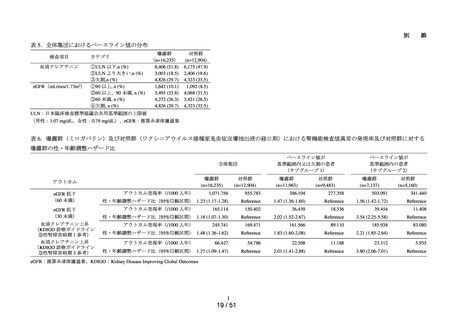
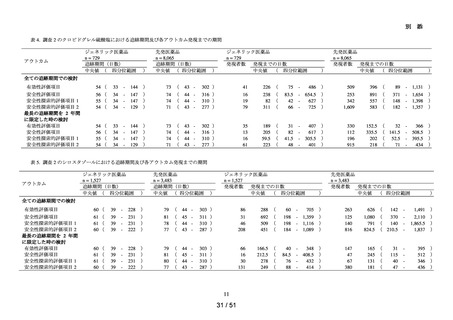
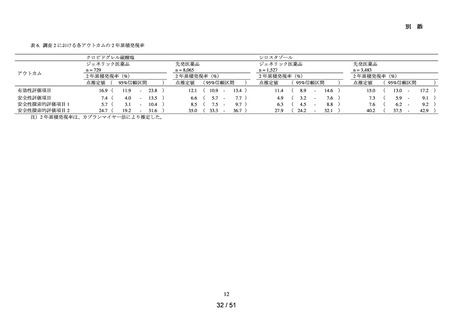
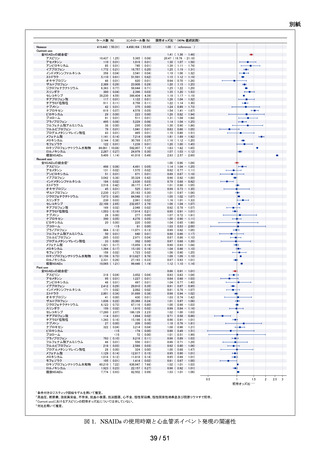
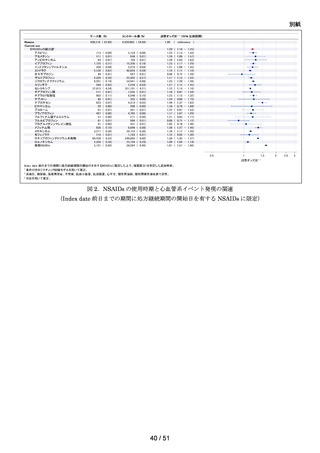
ACE 阻害薬処方後の肝機能障害に関連する検査値異常の発現頻度を比較し、ACE 阻害
薬の医薬品ごとの肝機能検査値異常の発現リスクの異同について評価する。
MID-NET®
選定理由 :臨床検査値を指標とした評価を実施するために選択
の選定理
データ期間に利用可能であった全ての MID-NET®協力医療機関(10 拠点 22
由とデー
病院)のデータを利用
タ期間
データ期間:2009 年 1 月 1 日~2019 年 12 月 31 日
調査方法
の概略
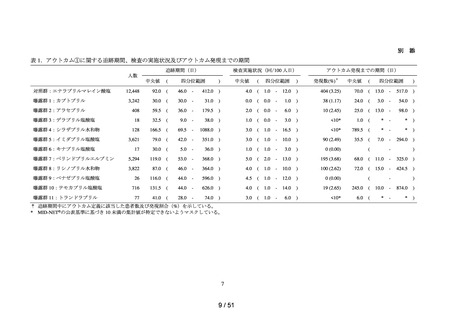
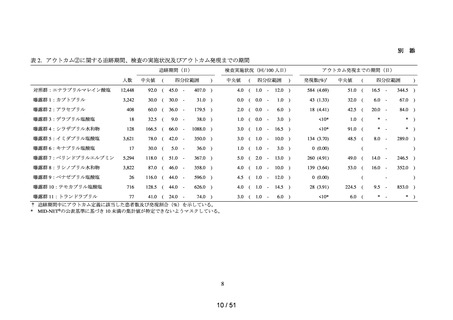
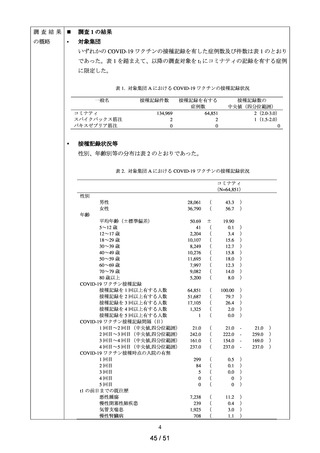
データ期間中に ACE 阻害薬の処方がある患者を対象として、追跡期間中の肝機能検
査値異常の発現状況を評価した。なお、ACE 阻害薬の新規処方の前 90 日間(新規処方
開始日を含む)に、①いずれかの肝機能検査値(アスパラギン酸アミノトランスフェラ
ーゼ(以下、「AST」)、アラニンアミノトランスフェラーゼ(以下、「ALT」)、アル
カリフォスファターゼ(以下、「ALP」)又は総ビリルビン(以下、「T-BIL」))にお
いてグレード 2†以上の異常がある患者(検査値ごとに最も新規処方開始日に近い時点で
測定された検査値で評価した)、②抗がん剤の処方又は放射線治療が実施されている患
者又は③B 型・C 型肝炎に対する抗ウイルス薬の処方がある患者を対象集団から除外し、
さらに④新規処方以降の追跡が不能な患者についても対象集団から除外した。新規処方
時点で処方された医薬品に応じて、対照群をエナラプリルマレイン酸塩、それ以外の医
薬品についてはそれぞれ曝露群として扱った。
新規処方の定義:
データ期間中の ACE 阻害薬の処方のうち、最も早い時点の処方であること。なお、
新規処方を適切に特定するために、新規処方の 91 日以上前に診療記録がない患者
についても対象集団から除外した。
追跡期間の定義:
ACE 阻害薬の新規処方開始日の翌日から、①最後の処方終了日の 30 日後、②新規
†
「医薬品等の副作用の重篤度分類基準について」(平成 4 年 6 月 29 日 薬安第 80 号 厚生省薬務局安全課長通知)を
基準に設定した(AST, グレード 1 以下:100 U/L 未満, グレード 2 以上:100 U/L 以上;ALT, グレード 1 以下:100
U/L 未満, グレード 2 以上:100 U/L 以上;ALP, グレード 1 以下:805 U/L 未満, グレード 2 以上:805 U/L 以上;TBIL, グレード 1 以下: 3.0 mg/dL 未満, グレード 2 以上:3.0 mg/dL 以上)。
1
3 / 51
MID-NET を用いた調査結果の概要
®
2024 年 8 月 27 日
調査・研究 MID-NET®を用いた ACE 阻害薬による肝障害関連指標への影響評価
の名称
調査対象
アラセプリル、イミダプリル塩酸塩、エナラプリルマレイン酸塩、カプトプリル、キナ
品目
プリル塩酸塩、シラザプリル水和物、テモカプリル塩酸塩、デラプリル塩酸塩、トラン
ドラプリル、ベナゼプリル塩酸塩、ペリンドプリルエルブミン、リシノプリル水和物
調査背景
◼
アンジオテンシン変換酵素阻害薬(以下、「ACE 阻害薬」)は、高血圧症に対して
広く使用されている医薬品であり、臨床試験等の結果を踏まえて、注意事項等情報
の「その他の副作用」の項にて、肝機能障害の関連事象について注意喚起がされて
いる。
◼
一方で、「重大な副作用」の項での注意喚起の状況は、医薬品によって異なってい
る(注意喚起がされている医薬品は、エナラプリルマレイン酸塩、テモカプリル塩
酸塩、トランドラプリル、ベナゼプリル塩酸塩及びリシノプリル水和物である)。
調査目的
ACE 阻害薬処方後の肝機能障害に関連する検査値異常の発現頻度を比較し、ACE 阻害
薬の医薬品ごとの肝機能検査値異常の発現リスクの異同について評価する。
MID-NET®
選定理由 :臨床検査値を指標とした評価を実施するために選択
の選定理
データ期間に利用可能であった全ての MID-NET®協力医療機関(10 拠点 22
由とデー
病院)のデータを利用
タ期間
データ期間:2009 年 1 月 1 日~2019 年 12 月 31 日
調査方法
の概略
データ期間中に ACE 阻害薬の処方がある患者を対象として、追跡期間中の肝機能検
査値異常の発現状況を評価した。なお、ACE 阻害薬の新規処方の前 90 日間(新規処方
開始日を含む)に、①いずれかの肝機能検査値(アスパラギン酸アミノトランスフェラ
ーゼ(以下、「AST」)、アラニンアミノトランスフェラーゼ(以下、「ALT」)、アル
カリフォスファターゼ(以下、「ALP」)又は総ビリルビン(以下、「T-BIL」))にお
いてグレード 2†以上の異常がある患者(検査値ごとに最も新規処方開始日に近い時点で
測定された検査値で評価した)、②抗がん剤の処方又は放射線治療が実施されている患
者又は③B 型・C 型肝炎に対する抗ウイルス薬の処方がある患者を対象集団から除外し、
さらに④新規処方以降の追跡が不能な患者についても対象集団から除外した。新規処方
時点で処方された医薬品に応じて、対照群をエナラプリルマレイン酸塩、それ以外の医
薬品についてはそれぞれ曝露群として扱った。
新規処方の定義:
データ期間中の ACE 阻害薬の処方のうち、最も早い時点の処方であること。なお、
新規処方を適切に特定するために、新規処方の 91 日以上前に診療記録がない患者
についても対象集団から除外した。
追跡期間の定義:
ACE 阻害薬の新規処方開始日の翌日から、①最後の処方終了日の 30 日後、②新規
†
「医薬品等の副作用の重篤度分類基準について」(平成 4 年 6 月 29 日 薬安第 80 号 厚生省薬務局安全課長通知)を
基準に設定した(AST, グレード 1 以下:100 U/L 未満, グレード 2 以上:100 U/L 以上;ALT, グレード 1 以下:100
U/L 未満, グレード 2 以上:100 U/L 以上;ALP, グレード 1 以下:805 U/L 未満, グレード 2 以上:805 U/L 以上;TBIL, グレード 1 以下: 3.0 mg/dL 未満, グレード 2 以上:3.0 mg/dL 以上)。
1
3 / 51