資料2-4 緊急承認された医薬品の市販後安全対策について[10.9MB] (109 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
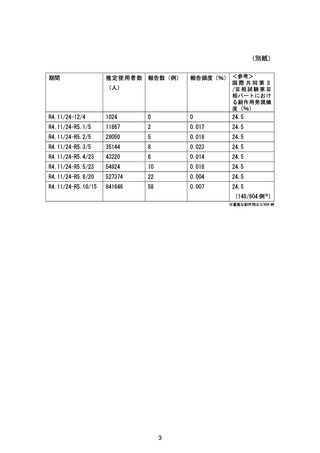
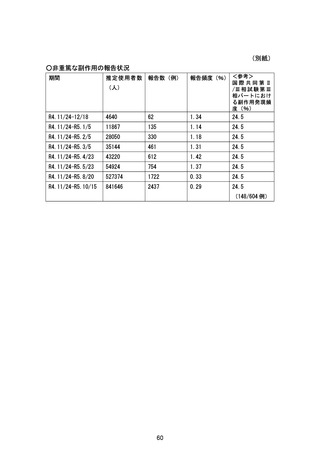
前回提出日:令和 5 年 6 月 28 日
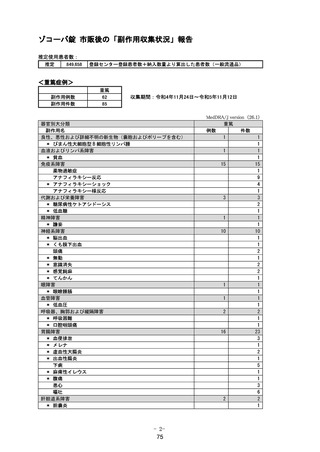
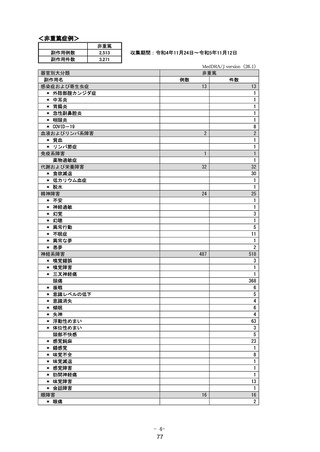
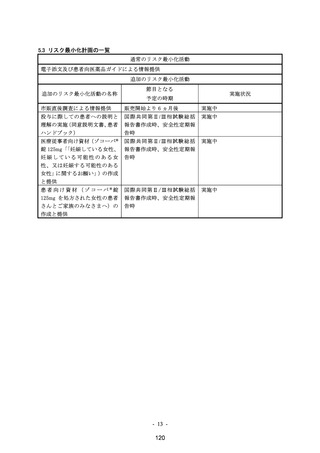
変更内容の概要:
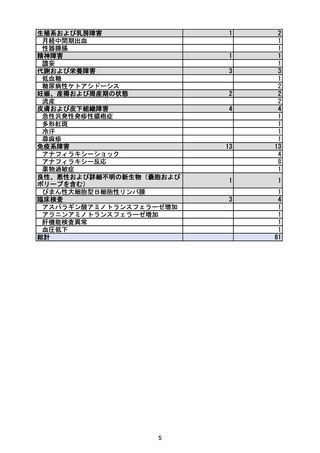
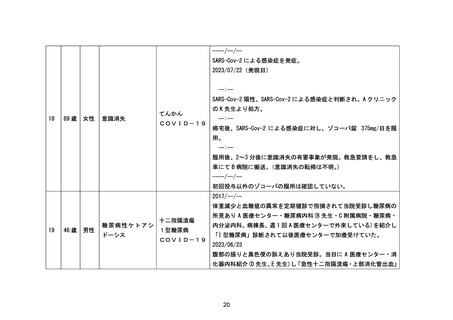
1. 重要な特定されたリスクに「アナフィラキシー」を追加
2. 一般使用成績調査実施計画書の改訂
3. 患者向け資材(ゾコーバ錠による治療に係る同意説明文書)の改訂
4. 患者向け資材〔ゾコーバ錠による治療を受ける患者さん・患者さんのご家族の方へ(患者
ハンドブック)〕の改訂
5. 国際共同第Ⅱ/Ⅲ相試験(T1221 試験)における第Ⅱb/Ⅲ相パートの実施状況及び報告書
の作成予定日の変更
変更理由:
1.~4. 製造販売後に「アナフィラキシー」の副作用症例が集積したため
5. 同試験を終了し、試験総括報告書を提出したため
- 2 -
109