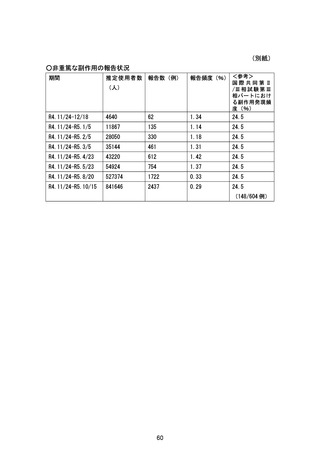
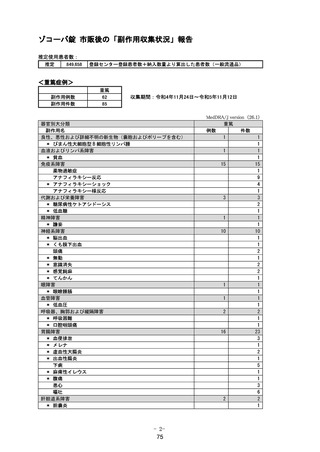
資料2-4 緊急承認された医薬品の市販後安全対策について[10.9MB] (76 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
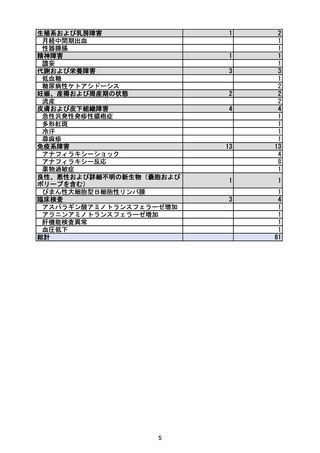
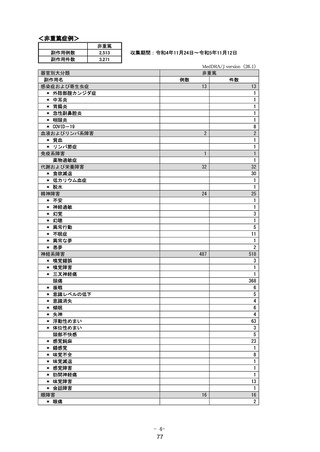
副作用名
* 劇症肝炎
皮膚および皮下組織障害
蕁麻疹
* 多形紅斑
* 急性汎発性発疹性膿疱症
* 冷汗
筋骨格系および結合組織障害
* 筋力低下
* 四肢痛
腎および尿路障害
* 急性腎障害
妊娠、産褥および周産期の状態
* 流産
生殖系および乳房障害
* 月経中間期出血
* 性器腫脹
一般・全身障害および投与部位の状態
* 低体温
* 発熱
* 顔面腫脹
* 全身性浮腫
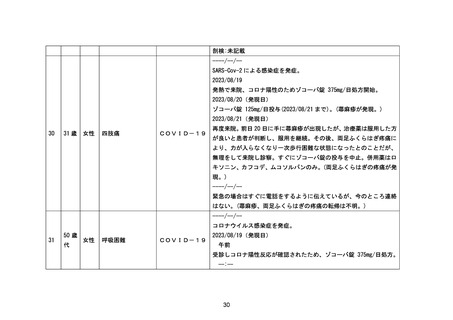
* 薬物相互作用
臨床検査
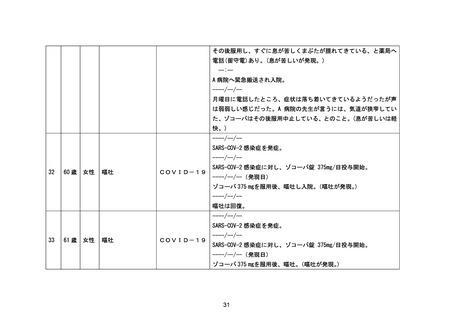
* 血圧低下
* アラニンアミノトランスフェラーゼ増加
* アスパラギン酸アミノトランスフェラーゼ増加
* 肝機能検査異常
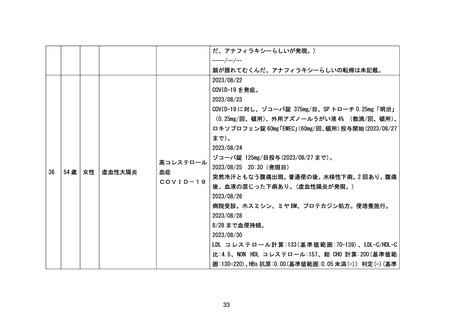
傷害、中毒および処置合併症
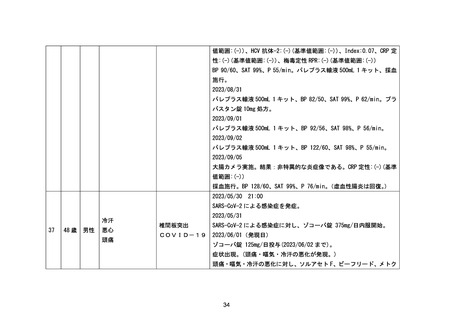
* 下肢骨折
重篤
例数
件数
5
2
1
2
1
6
4
1
1
5
2
1
1
1
2
1
1
1
1
2
2
2
1
1
6
1
1
1
1
2
6
1
2
2
1
1
1
(ご注意)
*印は「使用上の注意」から予測できない副作用を示します。因果関係が不明のものも副作用としてカウント
しています。
本報告書の「重篤」の件数には、「医師等から重篤と報告いただいたもの」もしくは「医師等からの報告では
非重篤でしたが、弊社内において重篤と判断したのもの」が含まれております。
なお、追跡調査等により、重篤性、因果関係、副作用症状名等が変更となる場合もありますのでご了承くださ
い。
- 376