資料2-4 緊急承認された医薬品の市販後安全対策について[10.9MB] (114 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
通常の医薬品安全性監視活動
通常の医薬品安全性監視活動の概要:
自発報告、文献・学会情報及び外国措置報告等の収集・確認・分析に基づく安全対策の検討及び
実行
追加の医薬品安全性監視活動
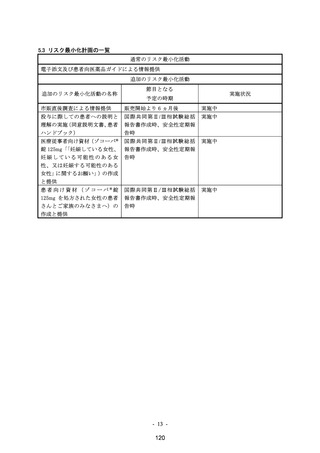
市販直後調査
実施期間:発売開始から 6 ヵ月間
評価、報告の予定時期:調査終了から 2 ヵ月以内
一般使用成績調査
【安全性検討事項】
アナフィラキシー
【目的】
使用実態下における本剤が投与された患者の安全性を確認する。また、有効性についても副次
的に情報を収集する。
【実施計画】
実施期間:2022 年 11 月から 2023 年 12 月
目標症例数:3000 例
実施方法:連続調査方式
観察期間:本剤の投与開始から 28 日間
【実施計画の根拠】
発現割合が 0.1%の副作用を 95%以上の確率で少なくとも 1 件以上検出可能な例数として、目
標症例数を 3000 例に設定した。
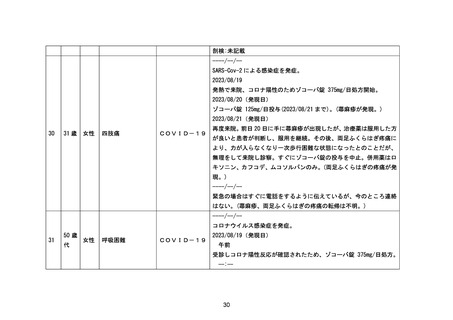
【節目となる予定の時期及びその根拠】
・ 調査開始半年後又は評価可能な症例の調査票データが 1000 例収集された時点のいずれか
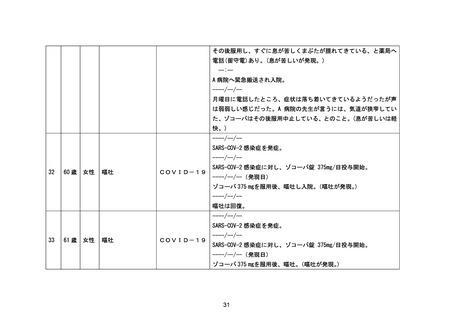
早い時点:主として安全性情報について包括的な検討を実施し、医療機関へ中間報告を行
う。
・ 安全性定期報告時:主として安全性情報について包括的な検討を実施する。
・ 調査終了時:本調査に登録されたすべての患者の観察期間が終了し、データを固定した段
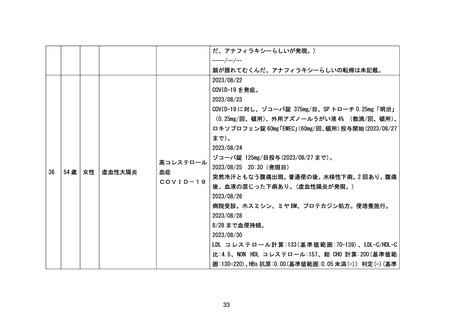
階で最終解析を実施する。得られた情報については早期に医療機関へ最終報告を行う。
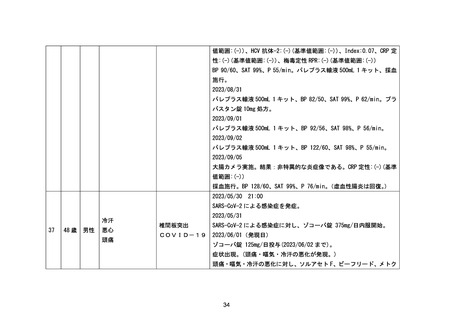
【当該医薬品安全性監視活動の結果に基づいて実施される可能性のある追加の措置及びその
開始の決定基準】
節目となる時期に、以下の内容を含めた医薬品リスク管理計画書の見直しを行う。
・ 新たな安全性検討事項の有無も含めて、本調査の計画内容の変更要否について検討を行う。
・ 新たな安全性検討事項に対する、リスク最小化策の策定要否について検討を行う。
肝機能障害を有する被験者を対象とした臨床薬理試験
【安全性検討事項】
中等度以上の肝機能障害患者での安全性
【目的】
肝機能障害患者における薬物動態を評価する
【実施計画】
実施国:米国
実施期間: 2022 年 7 月~2022 年 11 月
- 7 -
114