資料2-4 緊急承認された医薬品の市販後安全対策について[10.9MB] (110 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
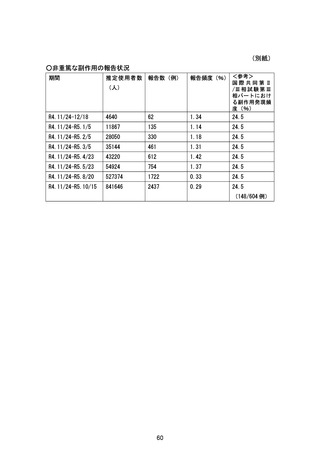
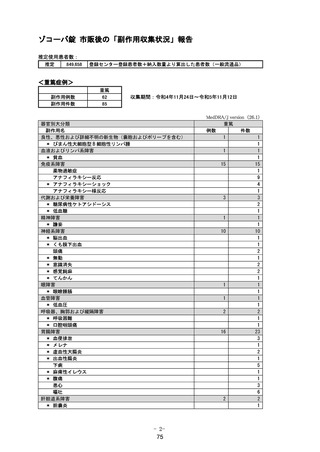
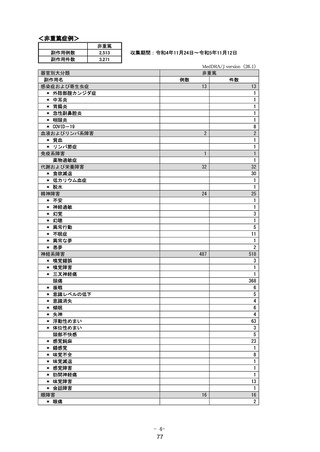
1.1 安全性検討事項
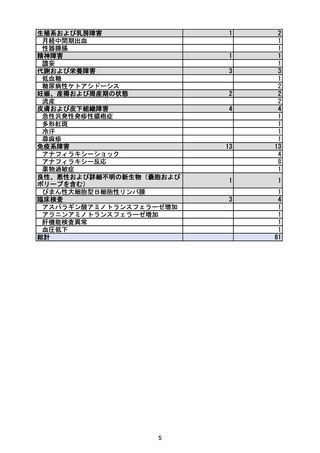
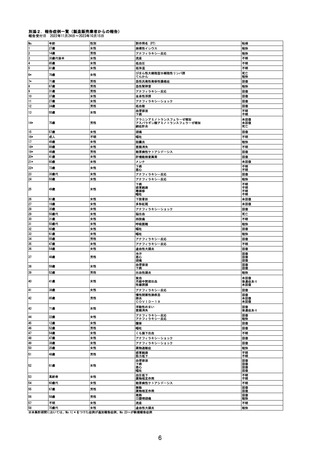
重要な特定されたリスク
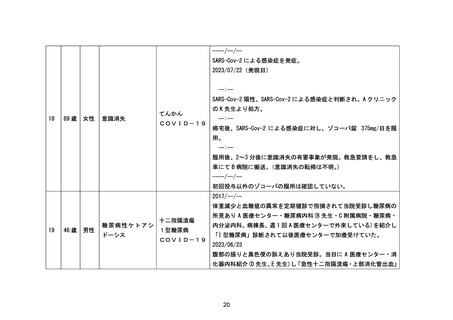
アナフィラキシー
重要な特定されたリスクとした理由:
国内製造販売後に本剤との因果関係が否定できないアナフィラキシーの症例が集積したこと
から、重要な特定されたリスクに設定した。
医薬品安全性監視活動の内容及びその選択理由:
【内容】
・ 通常の医薬品安全性監視活動
・ 追加の医薬品安全性監視活動
1. 一般使用成績調査
【選択理由】
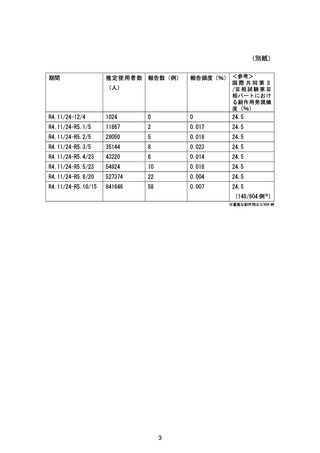
通常の医薬品安全性監視活動に加え一般使用成績調査を通じて情報を収集し、アナフィラキ
シーの発現状況を把握する。
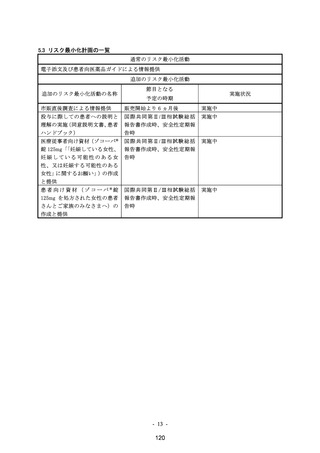
リスク最小化活動の内容及びその選択理由:
【内容】
・ 通常のリスク最小化活動として、電子添文の「11.1 重大な副作用」の項及び患者向医薬品
ガイドに記載して注意喚起する。
【選択理由】
本リスクに関する情報を医療従事者及び患者に提供することで、本剤の適正使用の理解を促
し、安全性の確保を図るため。
- 3 -
110