資料2-4 緊急承認された医薬品の市販後安全対策について[10.9MB] (119 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
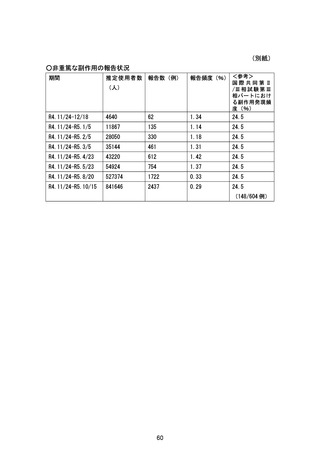
5.1 医薬品安全性監視計画の一覧
通常の医薬品安全性監視活動
自発報告、文献・学会情報及び外国措置報告等の収集・確認・分析に基づく安全対策の検討及び実
行
追加の医薬品安全性監視活動
追加の医薬品安全性監
節目となる症例数
節目となる
視活動の名称
/目標症例数
予定の時期
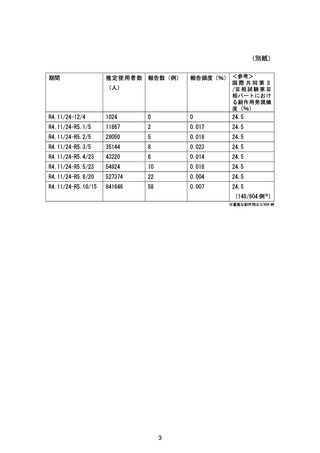
市販直後調査
該当せず
販売開始より 6
実施状況
実施中
ヵ月後
報告書の
作成予定日
市販直後調査
終了から 2 ヵ
月以内
一般使用成績調査
3000 例
・調査開始半年
実施中
調査開始 1.5 年
後又は評価可
後の安全性定
能な症例の調
期報告書作成
査票データが
時
1000 例収集さ
れた時点のい
ずれか早い時
点
・安全性定期報
告時
・調査終了時
肝機 能障 害を 有 する被
験者 を対 象と し た臨床
肝機能正常健康成人,
軽度肝機能障害患者
薬理試験
及び中等度肝機能障害
患者:各 8 例
試験総括報告
実施中
2023 年 12 月
書作成時
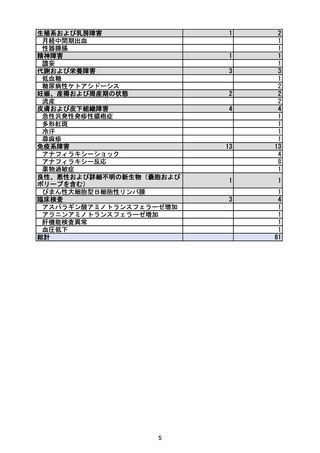
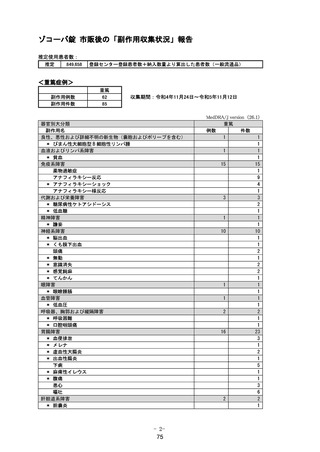
5.2 有効性に関する調査・試験の計画の一覧
有効性に関する調査・
試験の名称
節目となる症例数
/目標症例数
節目となる
予定の時期
国際共同第Ⅱ/Ⅲ相試験
(T1221 試験)
第Ⅲ相パート(軽症/中
等症の SARS-CoV-2 感
試験総括報告
書作成時
終了
作成済(2022 年
12 月提出)
試験総括報告
書作成時
終了
作成済(2023 年
実施状況
報告書の
作成予定日
染者):1590 例
第Ⅱb/Ⅲ相パート(無
症候/軽度症状のみ有
する SARS-CoV-2 感染
者):480 例
- 12 -
119
6 月提出)