資料2-4 緊急承認された医薬品の市販後安全対策について[10.9MB] (115 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
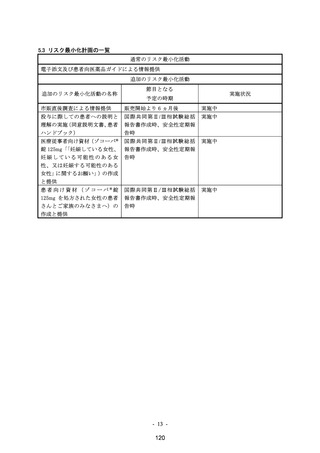
実施方法:オープンラベル,非ランダム化,並行群間比較試験
観察期間:本剤の投与開始から 21 日間
【実施計画の根拠】
一般的に、薬物動態パラメーター算出の目標症例数を 6 例に設定するが、中止・脱落を考慮の
うえ対象集団毎に 8 例に設定した。
【節目となる予定の時期及びその根拠】
・ 試験総括報告書作成時:目標症例数の集積が完了し、データを固定した段階で最終解析を
実施する。
【当該有効性に関する調査・試験の結果に基づいて実施される可能性のある追加の措置及びそ
の開始の決定基準】
節目となる時期に、以下の内容を含めた医薬品リスク管理計画書の見直しを行う。
・ 追加のリスク最小化策の策定要否について検討を行う。
- 8 -
115