よむ、つかう、まなぶ。
会議資料[11.8MB] (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41758.html |
| 出典情報 | 医療用から要指導・一般用への転用に関する評価検討会議(第28回 7/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
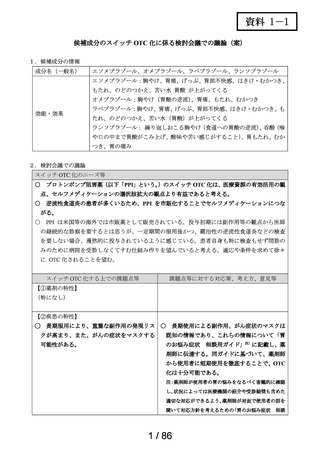
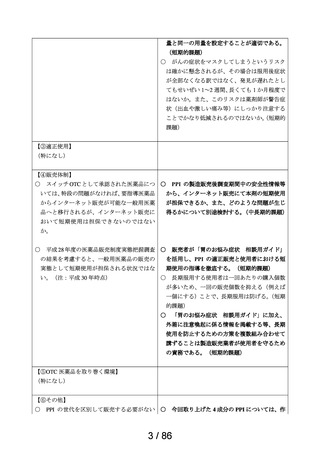
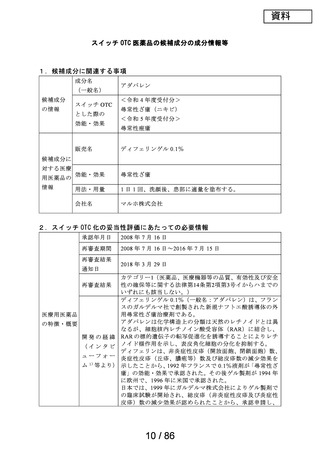
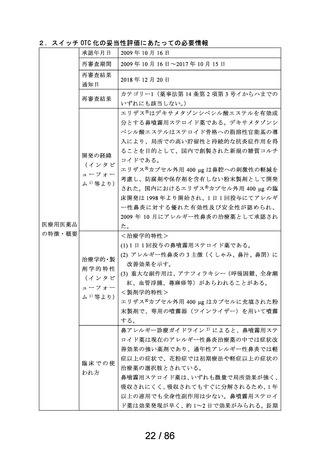
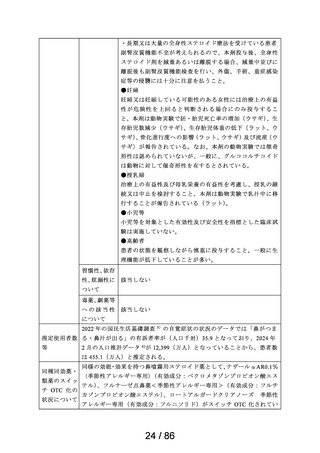
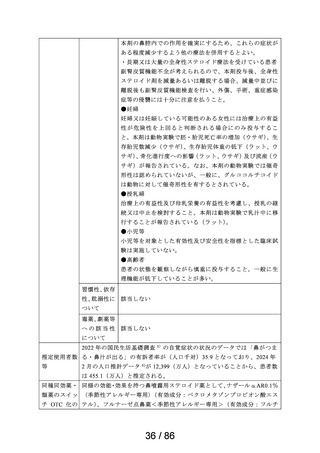
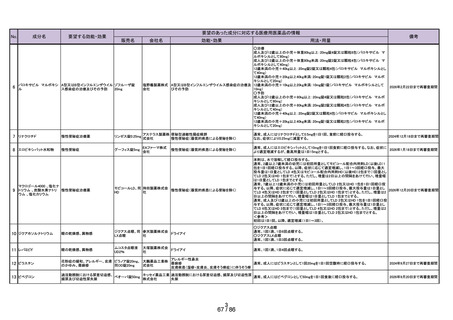
2.スイッチ OTC 化の妥当性評価にあたっての必要情報
承認年月日
2012 年 1 月 18 日
再審査期間
2012 年 1 月 18 日~2017 年 10 月 15 日
再審査結果
通知日
再審査結果
2018 年 12 月 20 日
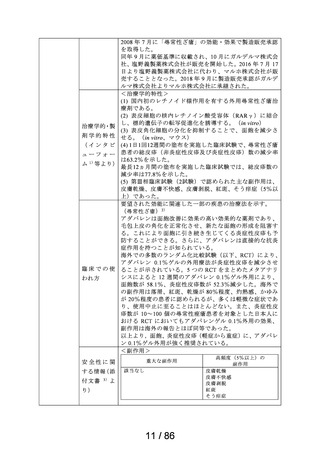
カテゴリー1(薬事法第 14 条第 2 項第 3 号イからハまでの
いずれにも該当しない。)
エリザス Ⓡ はデキサメタゾンシペシル酸エステルを有効成
分とする鼻噴霧用ステロイド薬である。デキサメタゾンシ
ペシル酸エステルはステロイド骨格への脂溶性官能基の導
入により、局所での高い貯留性と持続的な抗炎症作用を得
ることを目的として、国内で創製された新規の糖質コルチ
開発の経緯
(インタビ
ューフォー
ム 1 )等より)
コイドである。
エリザス Ⓡ カプセル外用 400 μg は鼻腔への刺激性の軽減を
考慮し、防腐剤や保存剤を含有しない粉末製剤として開発
された。国内におけるエリザス Ⓡ カプセル外用 400 μg の臨
床開発は 1998 年より開始され、1 日 1 回投与にてアレルギ
ー性鼻炎に対する優れた有効性及び安全性が認められ、
2009 年 10 月にアレルギー性鼻炎の治療薬として承認され
医療用医薬品
た。その後、エリザス Ⓡ カプセル外用 400 μg の内容物と組
の特徴・概要
成が同一の製剤粉末を噴霧器に充填したエリザス Ⓡ 点鼻粉
末 200 μg 28 噴霧用が 2012 年 1 月に承認された。
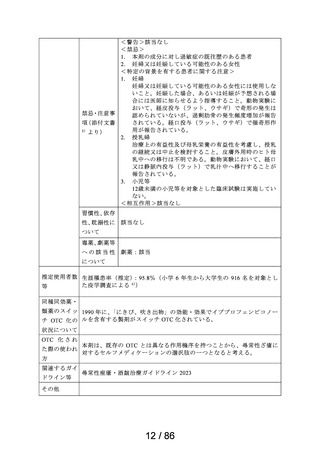
<治療学的特性>
(1) 1 日 1 回投与の鼻噴霧用ステロイド薬である。
治療学的・製
剤学的特性
(インタビ
ューフォー
ム 1 )等より)
(2) アレルギー性鼻炎の 3 主徴(くしゃみ、鼻汁、鼻閉)に
改善効果を示す。
(3) 重大な副作用は、アナフィラキシー(呼吸困難、全身潮
紅、血管浮腫、蕁麻疹等)があらわれることがある。
<製剤学的特性>
エリザス Ⓡ 点鼻粉末 200 μg 28 噴霧用は 14 日間分の製剤粉
末を噴霧器に充填した定量噴霧式の残数カウンター付き点
鼻粉末剤である。
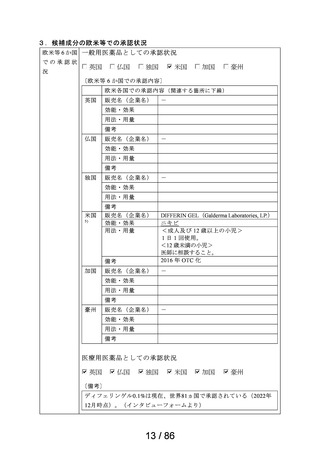
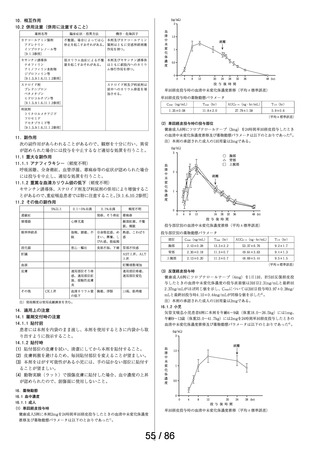
鼻アレルギー診療ガイドライン 2 ) によると、鼻噴霧用ステ
ロイド薬は現在のアレルギー性鼻炎治療薬の中では症状改
臨床での使
われ方
善効果の強い薬剤であり、通年性アレルギー性鼻炎では軽
症以上の症状で、花粉症では初期療法や軽症以上の症状の
治療薬の選択肢とされている。
鼻噴霧用ステロイド薬は、いずれも微量で局所効果が強く、
吸収されにくく、吸収されてもすぐに分解されるため、1 年
34 / 86
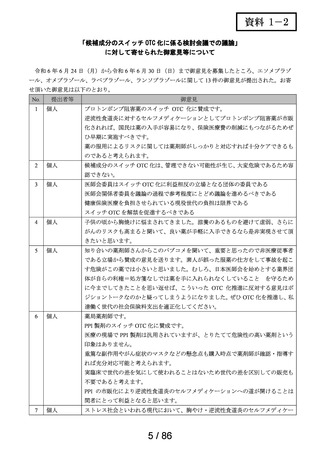
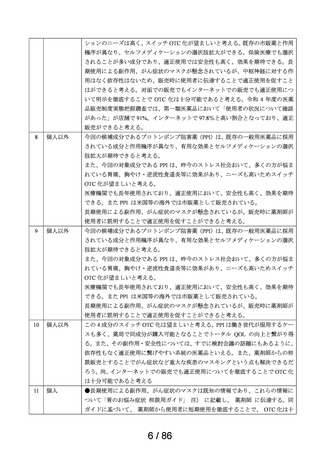
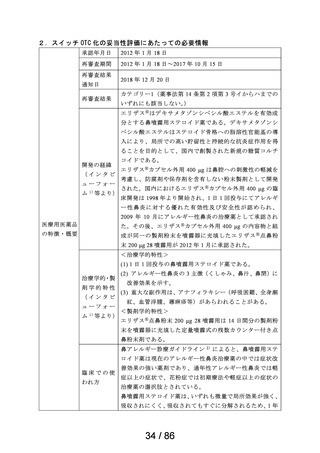
承認年月日
2012 年 1 月 18 日
再審査期間
2012 年 1 月 18 日~2017 年 10 月 15 日
再審査結果
通知日
再審査結果
2018 年 12 月 20 日
カテゴリー1(薬事法第 14 条第 2 項第 3 号イからハまでの
いずれにも該当しない。)
エリザス Ⓡ はデキサメタゾンシペシル酸エステルを有効成
分とする鼻噴霧用ステロイド薬である。デキサメタゾンシ
ペシル酸エステルはステロイド骨格への脂溶性官能基の導
入により、局所での高い貯留性と持続的な抗炎症作用を得
ることを目的として、国内で創製された新規の糖質コルチ
開発の経緯
(インタビ
ューフォー
ム 1 )等より)
コイドである。
エリザス Ⓡ カプセル外用 400 μg は鼻腔への刺激性の軽減を
考慮し、防腐剤や保存剤を含有しない粉末製剤として開発
された。国内におけるエリザス Ⓡ カプセル外用 400 μg の臨
床開発は 1998 年より開始され、1 日 1 回投与にてアレルギ
ー性鼻炎に対する優れた有効性及び安全性が認められ、
2009 年 10 月にアレルギー性鼻炎の治療薬として承認され
医療用医薬品
た。その後、エリザス Ⓡ カプセル外用 400 μg の内容物と組
の特徴・概要
成が同一の製剤粉末を噴霧器に充填したエリザス Ⓡ 点鼻粉
末 200 μg 28 噴霧用が 2012 年 1 月に承認された。
<治療学的特性>
(1) 1 日 1 回投与の鼻噴霧用ステロイド薬である。
治療学的・製
剤学的特性
(インタビ
ューフォー
ム 1 )等より)
(2) アレルギー性鼻炎の 3 主徴(くしゃみ、鼻汁、鼻閉)に
改善効果を示す。
(3) 重大な副作用は、アナフィラキシー(呼吸困難、全身潮
紅、血管浮腫、蕁麻疹等)があらわれることがある。
<製剤学的特性>
エリザス Ⓡ 点鼻粉末 200 μg 28 噴霧用は 14 日間分の製剤粉
末を噴霧器に充填した定量噴霧式の残数カウンター付き点
鼻粉末剤である。
鼻アレルギー診療ガイドライン 2 ) によると、鼻噴霧用ステ
ロイド薬は現在のアレルギー性鼻炎治療薬の中では症状改
臨床での使
われ方
善効果の強い薬剤であり、通年性アレルギー性鼻炎では軽
症以上の症状で、花粉症では初期療法や軽症以上の症状の
治療薬の選択肢とされている。
鼻噴霧用ステロイド薬は、いずれも微量で局所効果が強く、
吸収されにくく、吸収されてもすぐに分解されるため、1 年
34 / 86