よむ、つかう、まなぶ。
会議資料[11.8MB] (71 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41758.html |
| 出典情報 | 医療用から要指導・一般用への転用に関する評価検討会議(第28回 7/26)《厚生労働省》 |
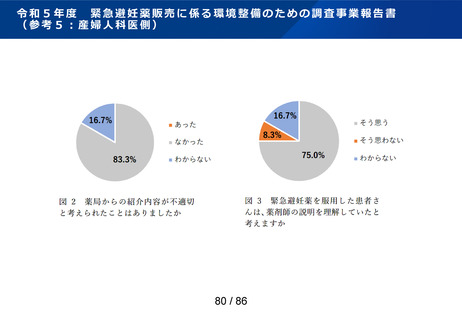
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
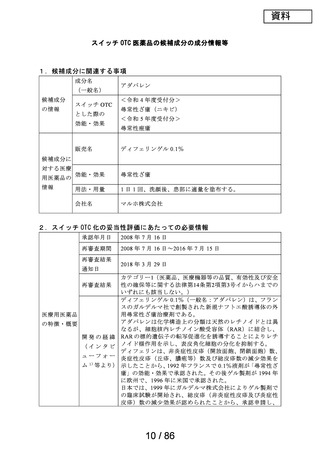
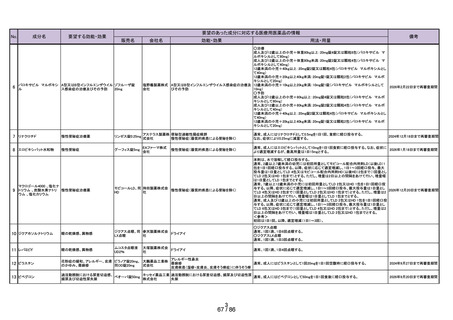
No.
成分名
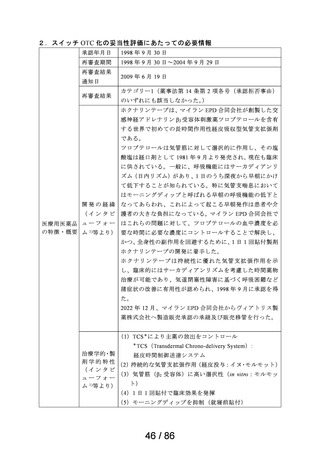
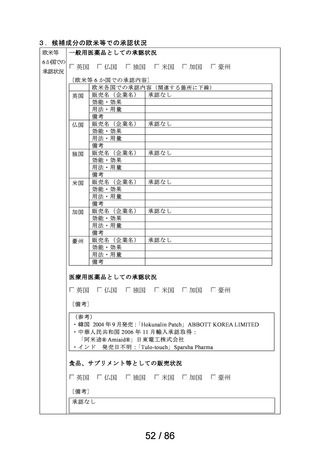
23 メトクロプラミド
ゲーファピキサントクエン酸
24 塩
25 オマリズマブ
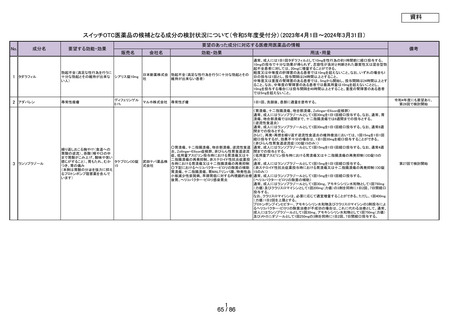
要望する効能・効果
要望のあった成分に対応する医療用医薬品の情報
販売名
会社名
効能・効果
用法・用量
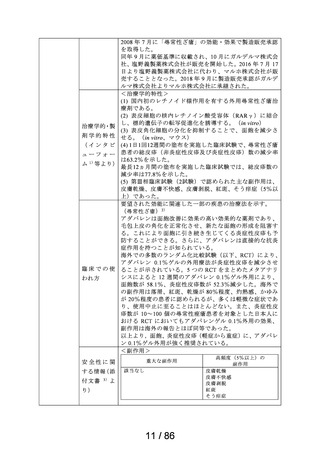
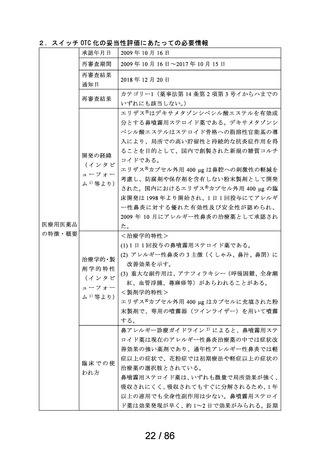
吐き気
プリンペラン錠5
○次の場合における消化器機能異常(悪心・嘔吐・食
欲不振・腹部膨満感)
胃炎、胃・十二指腸潰瘍、胆嚢・胆道疾患、腎炎、尿 メトクロプラミドとして、通常成人1日7.67~23.04mgを2~3回に分割し、食前に経口投与す
日医工株式会社 毒症、乳幼児嘔吐、薬剤(制癌剤・抗生物質・抗結核 る。
剤・麻酔剤)投与時、胃内・気管内挿管時、放射線照 なお、年齢、症状により適宜増減する。
射時、開腹術後
○X線検査時のバリウムの通過促進
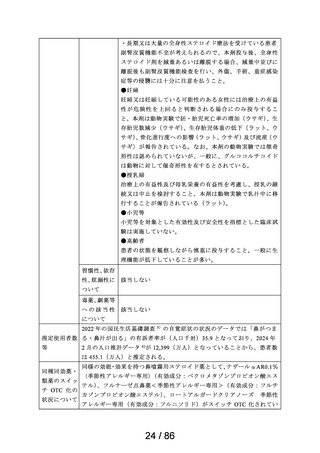
鎮咳
リフヌア錠45mg
MSD株式会社
花粉症
ゾレア皮下注
〈気管支喘息〉
75mgシリンジ、同
気管支喘息(既存治療によっても喘息症状をコント
通常、オマリズマブ(遺伝子組換え)として1回75~600mgを2又は4週間毎に皮下に注射
皮下注150mgシリ
ロールできない難治の患者に限る)
する。1回あたりの投与量並びに投与間隔は、初回投与前血清中総IgE濃度及び体重に
ンジ、同皮下注 ノバルティス
季節性アレルギー性鼻炎(既存治療で効果不十分な 基づき、下記の投与量換算表により設定する。
75mgペン、同皮 ファーマ株式会社 重症又は最重症患者に限る)注)
〈季節性アレルギー性鼻炎〉
下注150mgペン、
特発性の慢性蕁麻疹(既存治療で効果不十分な患者 通常、成人及び12歳以上の小児にはオマリズマブ(遺伝子組換え)として1回75~600mg
同皮下注300mg
に限る)
を2又は4週間毎に皮下に注射する。1回あたりの投与量並びに投与間隔は、初回投与前
ペン
血清中総IgE濃度及び体重に基づき、下記の投与量換算表により設定する。
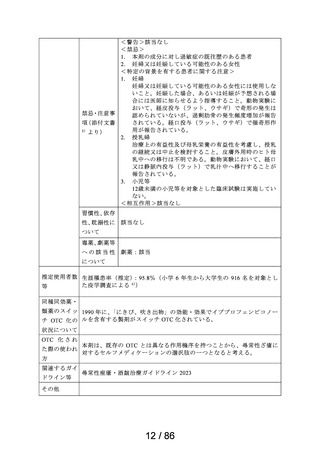
難治性の慢性咳嗽
通常、成人にはゲーファピキサントとして1回45mgを1日2回経口投与する。
5
69 / 86
備考
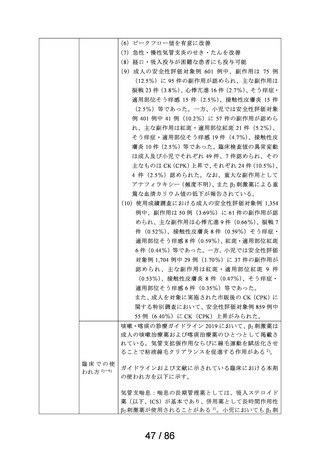
2030年1月19日まで再審査期間
資料6-3で議論
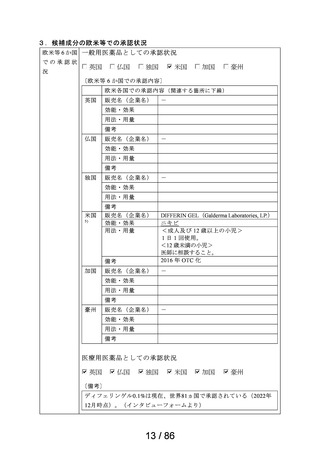
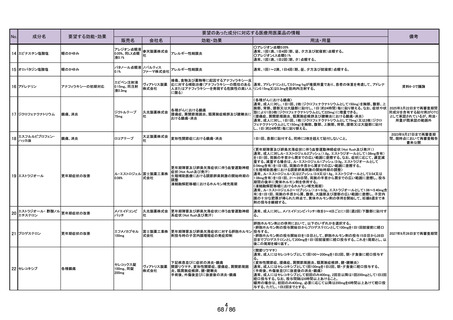
成分名
23 メトクロプラミド
ゲーファピキサントクエン酸
24 塩
25 オマリズマブ
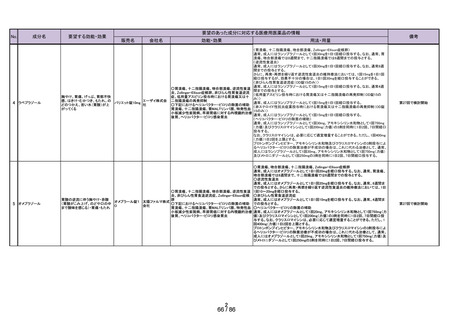
要望する効能・効果
要望のあった成分に対応する医療用医薬品の情報
販売名
会社名
効能・効果
用法・用量
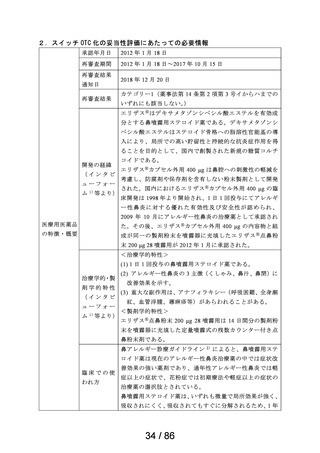
吐き気
プリンペラン錠5
○次の場合における消化器機能異常(悪心・嘔吐・食
欲不振・腹部膨満感)
胃炎、胃・十二指腸潰瘍、胆嚢・胆道疾患、腎炎、尿 メトクロプラミドとして、通常成人1日7.67~23.04mgを2~3回に分割し、食前に経口投与す
日医工株式会社 毒症、乳幼児嘔吐、薬剤(制癌剤・抗生物質・抗結核 る。
剤・麻酔剤)投与時、胃内・気管内挿管時、放射線照 なお、年齢、症状により適宜増減する。
射時、開腹術後
○X線検査時のバリウムの通過促進
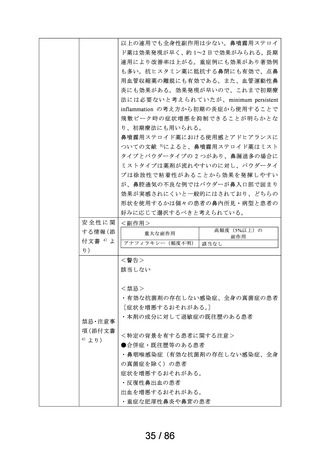
鎮咳
リフヌア錠45mg
MSD株式会社
花粉症
ゾレア皮下注
〈気管支喘息〉
75mgシリンジ、同
気管支喘息(既存治療によっても喘息症状をコント
通常、オマリズマブ(遺伝子組換え)として1回75~600mgを2又は4週間毎に皮下に注射
皮下注150mgシリ
ロールできない難治の患者に限る)
する。1回あたりの投与量並びに投与間隔は、初回投与前血清中総IgE濃度及び体重に
ンジ、同皮下注 ノバルティス
季節性アレルギー性鼻炎(既存治療で効果不十分な 基づき、下記の投与量換算表により設定する。
75mgペン、同皮 ファーマ株式会社 重症又は最重症患者に限る)注)
〈季節性アレルギー性鼻炎〉
下注150mgペン、
特発性の慢性蕁麻疹(既存治療で効果不十分な患者 通常、成人及び12歳以上の小児にはオマリズマブ(遺伝子組換え)として1回75~600mg
同皮下注300mg
に限る)
を2又は4週間毎に皮下に注射する。1回あたりの投与量並びに投与間隔は、初回投与前
ペン
血清中総IgE濃度及び体重に基づき、下記の投与量換算表により設定する。
難治性の慢性咳嗽
通常、成人にはゲーファピキサントとして1回45mgを1日2回経口投与する。
5
69 / 86
備考
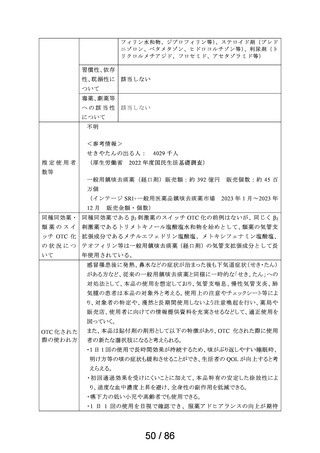
2030年1月19日まで再審査期間
資料6-3で議論