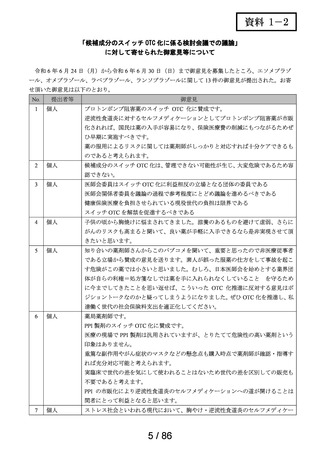
よむ、つかう、まなぶ。
会議資料[11.8MB] (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41758.html |
| 出典情報 | 医療用から要指導・一般用への転用に関する評価検討会議(第28回 7/26)《厚生労働省》 |
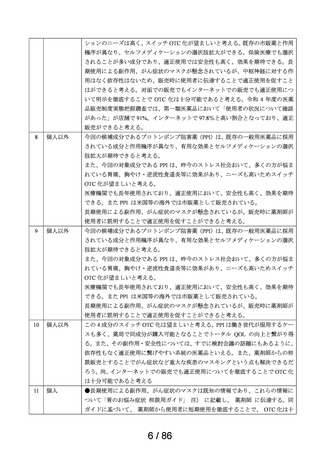
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
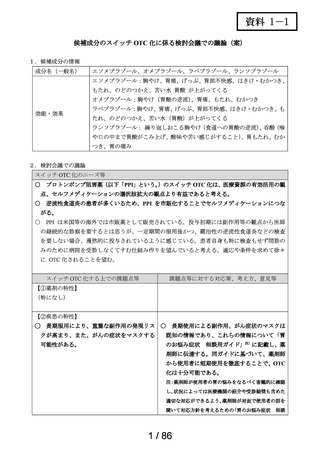
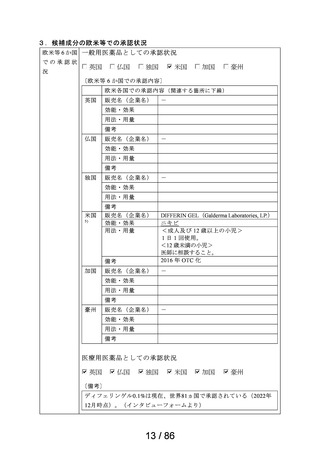
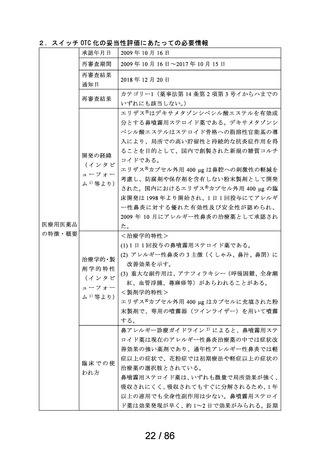
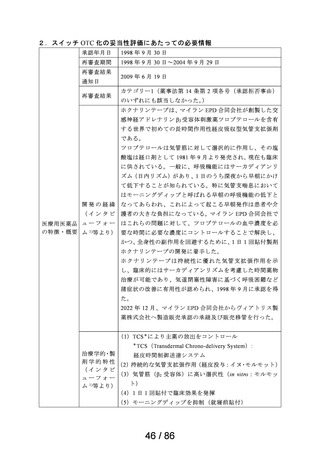
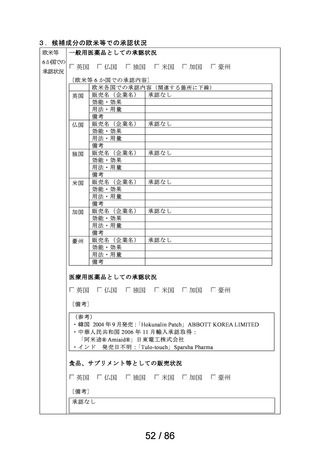
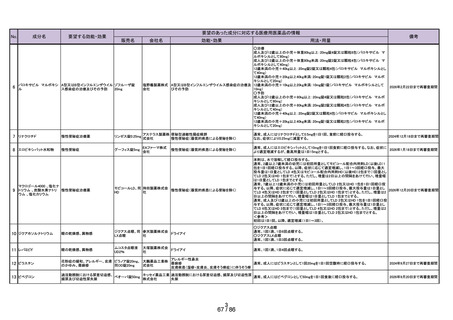
3.候補成分の欧米等での承認状況
欧米等 6 か国 一般用医薬品としての承認状況
での承認状
況
英国
仏国
独国
米国
加国
豪州
〔欧米等 6 か国での承認内容〕
欧米各国での承認内容 (関連する箇所に下線)
英国
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
仏国
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
独国
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
米国
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
加国
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
豪州
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
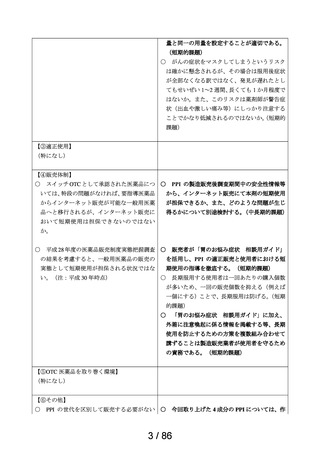
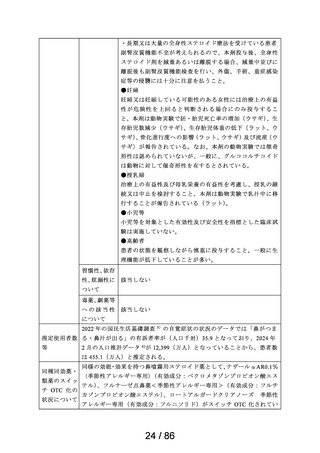
医療用医薬品としての承認状況
英国
仏国
独国
米国
〔備考〕
38 / 86
加国
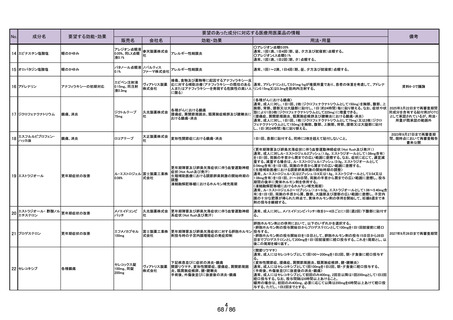
豪州
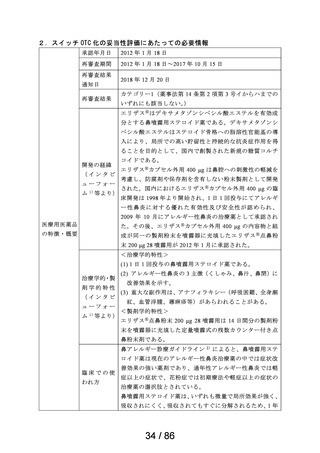
欧米等 6 か国 一般用医薬品としての承認状況
での承認状
況
英国
仏国
独国
米国
加国
豪州
〔欧米等 6 か国での承認内容〕
欧米各国での承認内容 (関連する箇所に下線)
英国
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
仏国
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
独国
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
米国
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
加国
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
豪州
販売名(企業名)
承認なし
効能・効果
用法・用量
備考
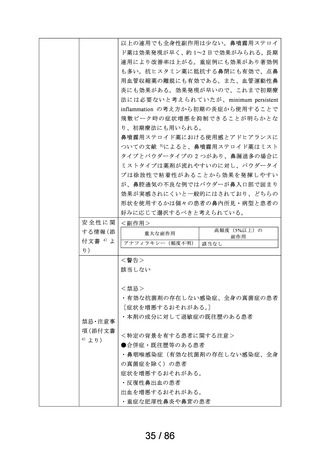
医療用医薬品としての承認状況
英国
仏国
独国
米国
〔備考〕
38 / 86
加国
豪州