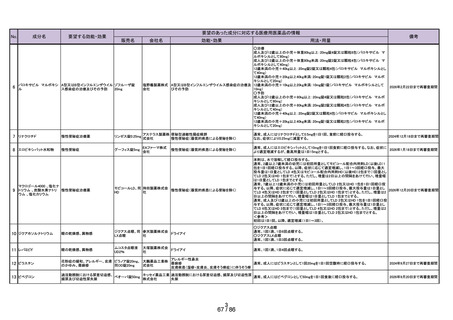
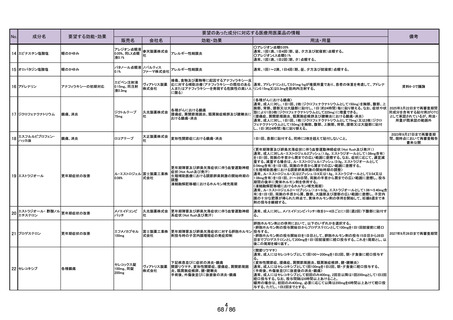
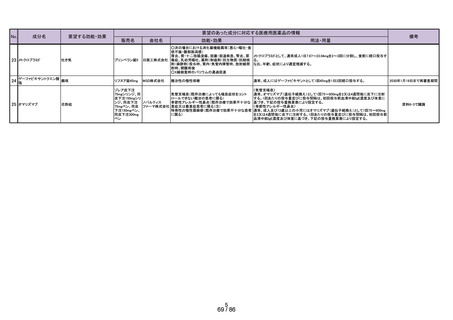
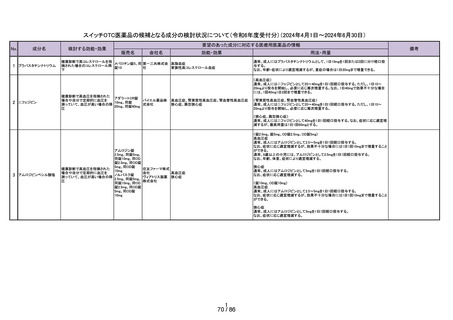
よむ、つかう、まなぶ。
会議資料[11.8MB] (43 ページ)
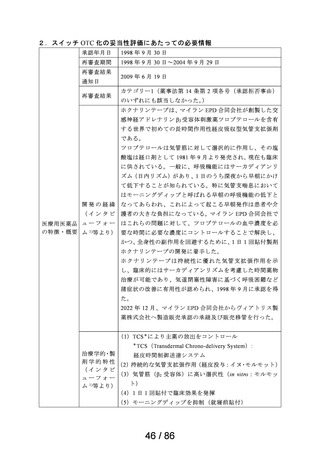
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41758.html |
| 出典情報 | 医療用から要指導・一般用への転用に関する評価検討会議(第28回 7/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
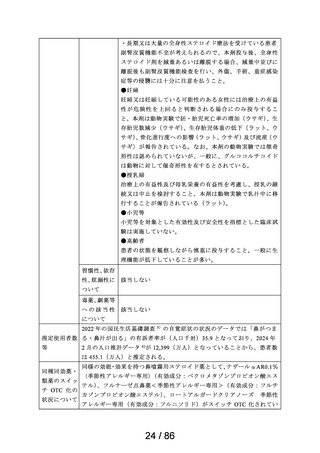
・鼻汁の多い場合は、十分算をかんだ後、噴邑させること。
・アルミ袋開封後は、なるべく速やかに使用するよう指導
すること。
15. その他の注意
15.1 臨床使用に基づく情報
レセルピン系製剤、 gc-メチルドパ製剤等の降圧剤には、副
作用として鼻閉がみられることがある。このような降圧剤
服用中のアレルギー性鼻炎の患者に、本剤を投与すると、
鼻閉症状に対する本剤の効果が隠蔽さきれるおそれがあるの
で、了臨床的観察を十分に行いながら投与すること。
16. 泉物動態
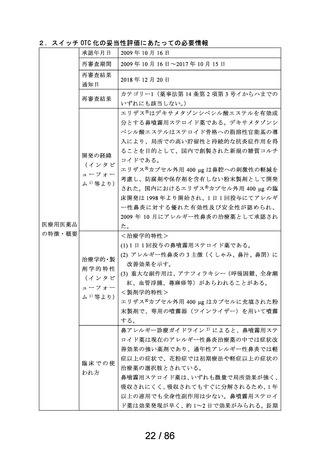
16.1 血中濃度
健康成人に本剤400ggを単回又は1日1回14日間反復鼻腔内噴霧 した
場合、血瞭中の未変化体及び主要活性代謝物である脱シクロへキサ
ンカルボン酸体濃度は、ともに定量下限 (16pg/mL) 未満であった。
健康成人に本剤800gg*) を1日1回14日間反復鼻腔内噴霧した場合、
6例中3例で血茜中に未変化体及び脱シクロヘへキサンカルボン酸体
が検出され、最高血聞中濃度 (Crz) は平均でそれぞれ35.9pg/mL
及び28.0pg/mLであったり 2。
16.3 分布
16.3.1 組織内移行 (参考)
ラットに殺標識したデキサメタゾンシペシル酸エステルを0.1mg/kg
鼻腔内投与した場合、投与後30分では、投与部位を含む頭部に投与
放射能の27.3%が存在したが、血液を含むその他の組織/器官では
0.1%以下であった。 大腸及び大脳を除くすべての組織の放射能濃度
が投与後2時間にC。。を示し、 最も多く存在した肝臓で0.7%であった3。
16.4 代謝
ヒト肝ミクロソーム及びヒト肝S9画分を用いた必 代謝試験に
おいて、デキサメタゾンシペシル酸エステルはカルボキシルエステ
ラーゼ (CES) により主要活性代謝物である脱シクロへキサンカル
ボン酸体に加水分解され、更にCYP3A4、CYP1A2及びCESにより
代謝されることが確認された?。
16.5 排洪
健康成人に本剤800ggを1日1回14日間反復鼻腔内噴霧した場合、尿
中には未変化体 (6例中1例) 及び主要活性代謝物である脱シクロへ
キサンカルボン酸体 (6例中5例) が検出されており、最終投与後72
時間までの尿中果積排港率はそれぞれ0.023%及び0.020%であった9?。
注) 本剤の承認された1日用量は400zgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第皿相試験
通年性アレルギー性鼻類患者406例を対象として、本剤400zg/日
(分1)、フルチカゾンプロピオォオン酸エステル (FP) 200zg/日 (分2)
又はプラセボ (分1) を2週間投与するランダム化二重盲検比較試験
を実施した。主要評価項目である3鼻症状 (くしゃみ発作、鼻汁及
び鼻閉) 合計スコアの変化量 (最終投与時投与前) を下表に記載
した。その結果、本剤のFPに対する非劣性が検証された (非劣性
限界値A=0.6)。また、本剤はプラセボ群に比し有意に優れている
ことが確認された (対応のないt{検定、P<0.001) ?。副作用発現頻
度は、本剤群で8.0% (13/162例) であった。主な副作用は、ALT
上昇1.2% (2/162例) であった。
第四相試験における3鼻症状合計スコア
投与前 変化量 群間差
投す笠 |例数 近作差) | (標準信差) | (95%信頼区間)
本剤400g/日| ,。。| 645 -203
(分1) (141) (195) | 本剤 vsFP
FP200ggH | ,。 | 640 -a0 VO7 (032-046)
(分2) (1.51) (1.77) 木剤 vs 本剤プラセボ
本剤プアモボ| 。。 6.41 093 |-111 (-1.58一-0.64)
(分1) (1.67) (1.39)
17.3 その他
17.3.1 下垂体・副腎機能への影響
健康成人に1日1回400g及び1日1回800gg を14日間、鼻腔内に反復
噴霧した場合、 下垂体・副腎皮質系機能の抑制は認められなかった!?②。
注) 本剤の承認された1日用量は400ggである。
18. 薬効薬理
18.1 作用機序
主として上鼻粘膜局所における、粘膜型肥満細胞・好酸球・リンパ球浸
潤の抑制、サイトカインの産生抑制、血管透過性及び腺分泌の抑制、
アラキドン酸代謝阻害によるロイコトリエン・プロスタグランジン産
生の抑制等の抗炎症作用・抗アレルギー作用が寄与すると考えられる。
18.2 抗アレルギー作用
感作モルモットのアレルギー性鼻炎モデルにおいて、点鼻投与によ
り 鼻炎誘発後30分間のくしゃみ発現回数を軽減し、誘発後3ー7時間
の鼻閉 (鼻腔抵抗値) を軽減した。その効果は、フルチカゾンプロ
ピオン酸エステルと同程度であった@。
19. 有効成分に関する理化学的知見
一般名 : デキサメタゾンシペシル酸エステル (Dexamethasone
cipecilate) (TAN)
化学名 : 9-Fluoro-11/, 17,21-trihydroxy-16g-methylpregna-
1.4-diene-3,20-dione 21-cyclohexanecarboxylate
17-cyclopropanecarboxylate
分子式 : CssH4sFO7
分子量 : 570.69
化学構造式 :
性状 : 白色の結晶性の粉末である。 W,W-ジメチルホルムアミド、テ
トラヒドロフランにやや溶けやすく、アセトニトリル、メタノール
又はエタノール (99.5) に溶けにくく、水にほとんど溶けない。
融点 : 約269C (分解)
20. 取扱い上の注意
使用期間中は、アルミ袋に入れてチャックを閉じ、高温、多湿を訂
けて保管させること。
22. 包装
2本、10本
23. 主要文献
1) 奥田 稔:耳鼻乃床. 2010:103 (1) :85-98
2) 奥田 稔:耳鼻了臨床. 2010103 (3) :277-86
3) 社内資料 : デキサメタゾンシペシル酸エステルの薬物動態試験
(1) ラットにおける吸収、分布及び代謝
4) 社内資料: デキサメタゾンシペシル酸エステルの楽物動上試験
(2) 太 層みo及び太 立の代放
5) 奥田 稔ほか : 耳鼻際床. 2010:補127:1-16
6) Inoue N, ez 〆. : 本 Pharmacol Sci. 2010:112 (1) :73-82
24. 文献請求先及び問い合わせ先
日本新薬株式会社 製品情報担当
〒601-8550 京都市南区吉祥院西ノ庄門口町14
フリーダイヤル 0120-321-372
TEL 075-321-9064
FAX 075-321-9061
26. 製造販売業者等
26.1 製造販売元
日本新薬株式会社
京都市南区吉祥院西ノ庄門口町14
41/66
D15-04
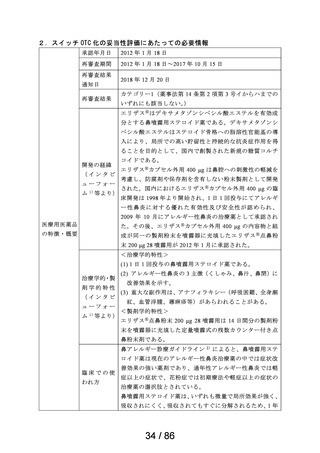
・アルミ袋開封後は、なるべく速やかに使用するよう指導
すること。
15. その他の注意
15.1 臨床使用に基づく情報
レセルピン系製剤、 gc-メチルドパ製剤等の降圧剤には、副
作用として鼻閉がみられることがある。このような降圧剤
服用中のアレルギー性鼻炎の患者に、本剤を投与すると、
鼻閉症状に対する本剤の効果が隠蔽さきれるおそれがあるの
で、了臨床的観察を十分に行いながら投与すること。
16. 泉物動態
16.1 血中濃度
健康成人に本剤400ggを単回又は1日1回14日間反復鼻腔内噴霧 した
場合、血瞭中の未変化体及び主要活性代謝物である脱シクロへキサ
ンカルボン酸体濃度は、ともに定量下限 (16pg/mL) 未満であった。
健康成人に本剤800gg*) を1日1回14日間反復鼻腔内噴霧した場合、
6例中3例で血茜中に未変化体及び脱シクロヘへキサンカルボン酸体
が検出され、最高血聞中濃度 (Crz) は平均でそれぞれ35.9pg/mL
及び28.0pg/mLであったり 2。
16.3 分布
16.3.1 組織内移行 (参考)
ラットに殺標識したデキサメタゾンシペシル酸エステルを0.1mg/kg
鼻腔内投与した場合、投与後30分では、投与部位を含む頭部に投与
放射能の27.3%が存在したが、血液を含むその他の組織/器官では
0.1%以下であった。 大腸及び大脳を除くすべての組織の放射能濃度
が投与後2時間にC。。を示し、 最も多く存在した肝臓で0.7%であった3。
16.4 代謝
ヒト肝ミクロソーム及びヒト肝S9画分を用いた必 代謝試験に
おいて、デキサメタゾンシペシル酸エステルはカルボキシルエステ
ラーゼ (CES) により主要活性代謝物である脱シクロへキサンカル
ボン酸体に加水分解され、更にCYP3A4、CYP1A2及びCESにより
代謝されることが確認された?。
16.5 排洪
健康成人に本剤800ggを1日1回14日間反復鼻腔内噴霧した場合、尿
中には未変化体 (6例中1例) 及び主要活性代謝物である脱シクロへ
キサンカルボン酸体 (6例中5例) が検出されており、最終投与後72
時間までの尿中果積排港率はそれぞれ0.023%及び0.020%であった9?。
注) 本剤の承認された1日用量は400zgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第皿相試験
通年性アレルギー性鼻類患者406例を対象として、本剤400zg/日
(分1)、フルチカゾンプロピオォオン酸エステル (FP) 200zg/日 (分2)
又はプラセボ (分1) を2週間投与するランダム化二重盲検比較試験
を実施した。主要評価項目である3鼻症状 (くしゃみ発作、鼻汁及
び鼻閉) 合計スコアの変化量 (最終投与時投与前) を下表に記載
した。その結果、本剤のFPに対する非劣性が検証された (非劣性
限界値A=0.6)。また、本剤はプラセボ群に比し有意に優れている
ことが確認された (対応のないt{検定、P<0.001) ?。副作用発現頻
度は、本剤群で8.0% (13/162例) であった。主な副作用は、ALT
上昇1.2% (2/162例) であった。
第四相試験における3鼻症状合計スコア
投与前 変化量 群間差
投す笠 |例数 近作差) | (標準信差) | (95%信頼区間)
本剤400g/日| ,。。| 645 -203
(分1) (141) (195) | 本剤 vsFP
FP200ggH | ,。 | 640 -a0 VO7 (032-046)
(分2) (1.51) (1.77) 木剤 vs 本剤プラセボ
本剤プアモボ| 。。 6.41 093 |-111 (-1.58一-0.64)
(分1) (1.67) (1.39)
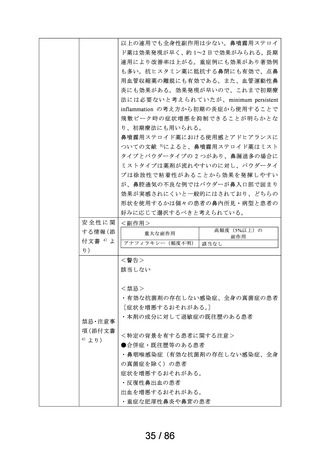
17.3 その他
17.3.1 下垂体・副腎機能への影響
健康成人に1日1回400g及び1日1回800gg を14日間、鼻腔内に反復
噴霧した場合、 下垂体・副腎皮質系機能の抑制は認められなかった!?②。
注) 本剤の承認された1日用量は400ggである。
18. 薬効薬理
18.1 作用機序
主として上鼻粘膜局所における、粘膜型肥満細胞・好酸球・リンパ球浸
潤の抑制、サイトカインの産生抑制、血管透過性及び腺分泌の抑制、
アラキドン酸代謝阻害によるロイコトリエン・プロスタグランジン産
生の抑制等の抗炎症作用・抗アレルギー作用が寄与すると考えられる。
18.2 抗アレルギー作用
感作モルモットのアレルギー性鼻炎モデルにおいて、点鼻投与によ
り 鼻炎誘発後30分間のくしゃみ発現回数を軽減し、誘発後3ー7時間
の鼻閉 (鼻腔抵抗値) を軽減した。その効果は、フルチカゾンプロ
ピオン酸エステルと同程度であった@。
19. 有効成分に関する理化学的知見
一般名 : デキサメタゾンシペシル酸エステル (Dexamethasone
cipecilate) (TAN)
化学名 : 9-Fluoro-11/, 17,21-trihydroxy-16g-methylpregna-
1.4-diene-3,20-dione 21-cyclohexanecarboxylate
17-cyclopropanecarboxylate
分子式 : CssH4sFO7
分子量 : 570.69
化学構造式 :
性状 : 白色の結晶性の粉末である。 W,W-ジメチルホルムアミド、テ
トラヒドロフランにやや溶けやすく、アセトニトリル、メタノール
又はエタノール (99.5) に溶けにくく、水にほとんど溶けない。
融点 : 約269C (分解)
20. 取扱い上の注意
使用期間中は、アルミ袋に入れてチャックを閉じ、高温、多湿を訂
けて保管させること。
22. 包装
2本、10本
23. 主要文献
1) 奥田 稔:耳鼻乃床. 2010:103 (1) :85-98
2) 奥田 稔:耳鼻了臨床. 2010103 (3) :277-86
3) 社内資料 : デキサメタゾンシペシル酸エステルの薬物動態試験
(1) ラットにおける吸収、分布及び代謝
4) 社内資料: デキサメタゾンシペシル酸エステルの楽物動上試験
(2) 太 層みo及び太 立の代放
5) 奥田 稔ほか : 耳鼻際床. 2010:補127:1-16
6) Inoue N, ez 〆. : 本 Pharmacol Sci. 2010:112 (1) :73-82
24. 文献請求先及び問い合わせ先
日本新薬株式会社 製品情報担当
〒601-8550 京都市南区吉祥院西ノ庄門口町14
フリーダイヤル 0120-321-372
TEL 075-321-9064
FAX 075-321-9061
26. 製造販売業者等
26.1 製造販売元
日本新薬株式会社
京都市南区吉祥院西ノ庄門口町14
41/66
D15-04