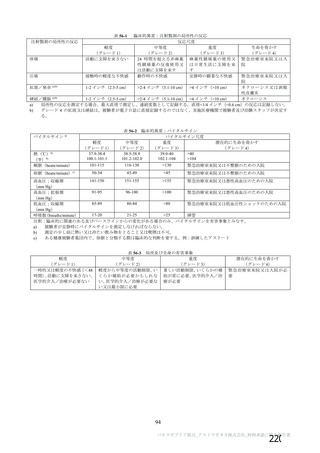
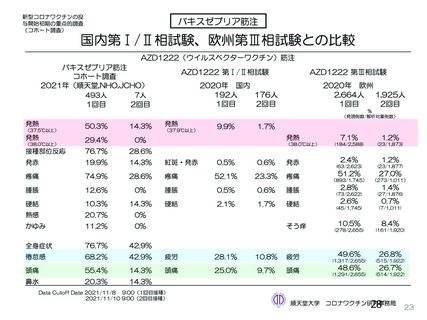
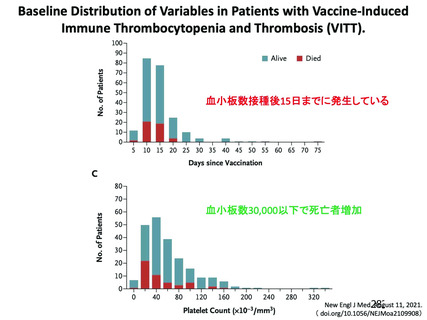
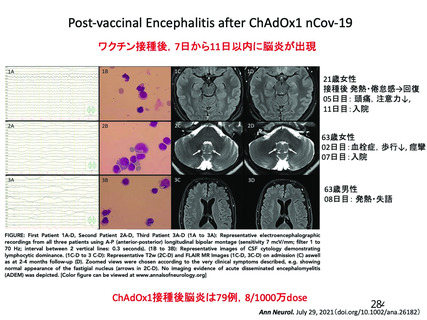
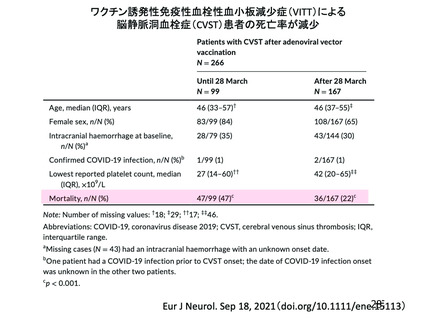
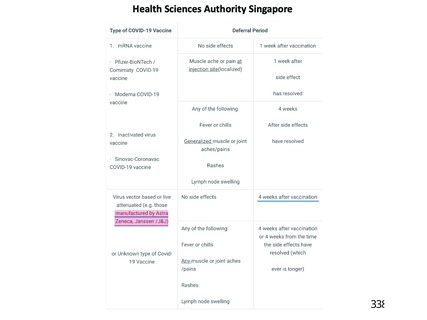
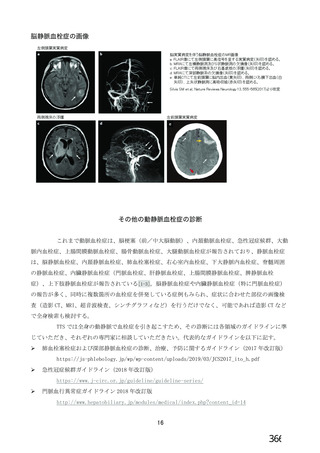
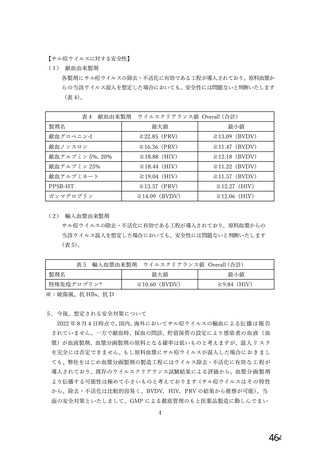
資 料4-2-➁ 令和4年度第2回安全技術調査会の審議結果について➁ (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
立行政法人医薬品医療機器総合機構に提出するとともに、本剤の有効性及び安全性に係る最
新の情報を、医療従事者及び被接種者が容易に入手可能となるよう必要な措置を講じること。
また、国が行う本剤の有効性及び安全性に係る情報の発信について、適切に協力すること。
(4) 本剤は、医薬品医療機器等法第 14 条の 3 第 1 項の規定に基づき承認された特例承認品目で
あり、承認時において長期安定性等に係る情報は限られているため、製造販売後も引き続き
情報を収集し、報告すること。
(5) 本剤の接種に際し、本剤の有効性及び安全性については今後も情報が集積されることを踏ま
え、あらかじめ被接種者又は代諾者に最新の有効性及び安全性に関する情報が文書をもって
説明され、予診票等で文書による同意を得てから接種されるよう、医師に対して適切に説明
すること。
(6) 医薬品医療機器等法施行規則第 41 条に基づく資料の提出の猶予期間は、承認取得から起算
して 6 カ月とする。上記に基づいて提出された資料等により、承認事項を変更する必要が認
められた場合には、医薬品医療機器等法第 74 条の 2 第 3 項に基づき承認事項の変更を命ず
ることがあること。
3.
本剤は、医薬品医療機器等法第 14 条の 3 第 1 項に基づく承認であるため、同法第 75 条の 3 の規
定により、同法第 14 条の 3 第 1 項各号のいずれかに該当しなくなったと認めるとき、又は保健衛
生上の危害の発生若しくは拡大を防止するため必要があると認めるときは、これらの承認を取り
消すことがあること。
以上
113
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
239