資 料4-2-➁ 令和4年度第2回安全技術調査会の審議結果について➁ (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
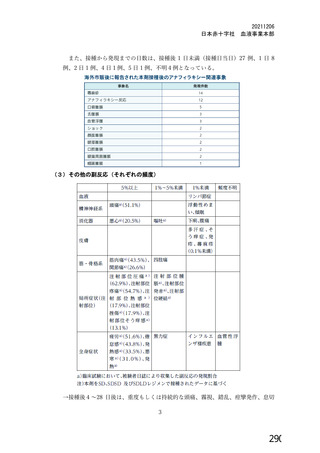
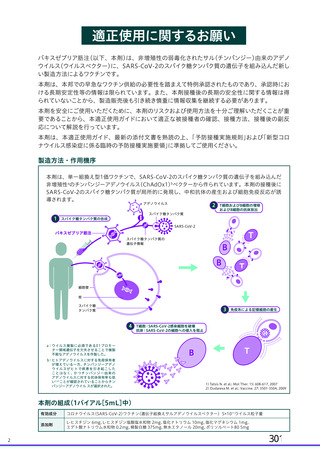
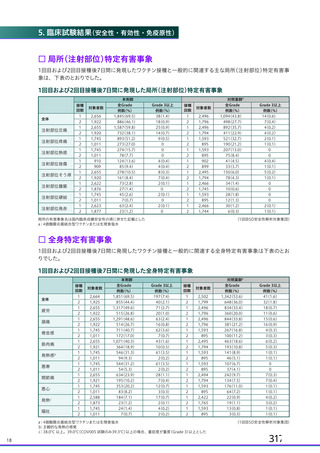
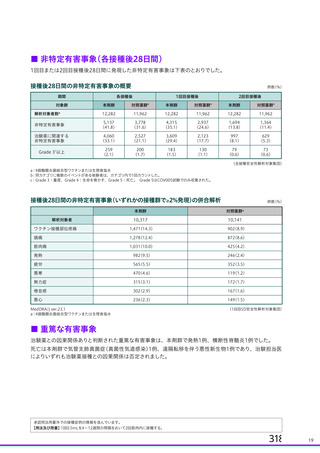
る副反応の発現割合が COV001 試験と比較して低かったため、さらに調査したところ、吸光度法を用い
た定量試験では添加剤のポリソルベート 80 による予想外の干渉が生じることが判明した。壮請議 提
の治験薬の一部のロット (ロット 請軒| 詞較 oc欄議) では、原因不有明であるもののポリソル
ベート 80 が約 2 倍量含まれており、ポリソルベート 80 は吸光度を増幅させるため、ウイルス粒子の濃
度が過大評価されていた。その結果、COV002 試験の一部の被験者 (1、 2、4 及び3 群の一部) では、バ
イアル中の製剤の濃度が過剰に希邊されて、意図した用量の 45%の用量が接種さんた。なお、ポリソル
ベート 80 は、 凝集からアデノウイルス粒子を安定化させるための添加剤と して使用しており、 これらの
製剤のロットで観察された高濃度のポリソルベート 80 が、製剤品質と安定性に影響を及ぼすことはな
い。その後、MHRA 及びDSMB からの承認を得て、qPCR 法の方が分析精度は高いことから、その後の
SD 用量の調製には qPCR 法を用いた測定値で?X100 vp となる用量を選択することが決定された。
COV005 試験では、軒請軒 寺により qPCR 法で測定された製剤のウイルス粒子濃度が過大評価されて
おり、 初期の一部の被験者 (2a 及び 2b 群) が標準用量より低用量の接種を受けていた。当該事象は、申
請者 (アストラゼネカ社) の遡及的な測定により判明したものであり、市販用に最適化された qPCR 法
及び digital dropletPCR (ddPCR) 法を用いてウイルス粒子濃度を再測定したところ、壮請請福揚の製剤
ロット 較請較 に関する qPCR 法によるデータは実際よりも過大評価されていた。 南アフリカ規制当局と
の協議の結果、再測定で得られた値に基づき、他の試験での SD に相当する用量が得られるように接種
容量を調整することとなった。
以上のことから、併合解析では、本剤の各用量 (SD 又はLD) について以下の分類法を用いて分類さ
れた (11.1 項参照) 。
・ 吸光度法又は qPCR 法で測定した $X10" vp を SD とする。これには、土30% (3.5て6.5X10! yp)
の範囲の製剤が含まれる。
・ qPCR 法で測定した 2一2.5X100vyp をLD とする。
上記のように、併合解析の解析対象集団には、一つの接種群 (LD 又は SD) の中に異なる定量方法を
用いて設定された用量を接種された被験者が含まれる。 申請者は、臨床試験で使用された製剤を異なる
3 つの製法で異なる 3 つの製造所において製造したものの、各製剤の同等性同質性を確認しており、
各製剤の SD 用量におけるウイルス粒子濃度、ウイルス粒子あたりの感染価について明確な違いは認め
られていないことから (2.R.2 項参照) 、 製剤の分析方法の変更に伴う本剤の臨床試験成績の評価に及ぼ
す影響はないと説明している。
以上
100
遇人 226