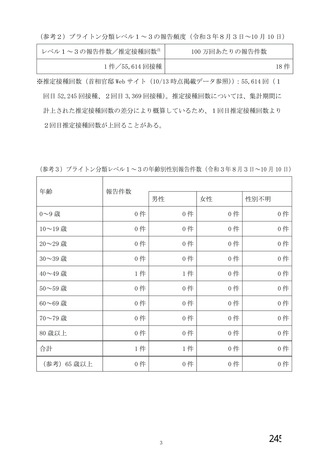
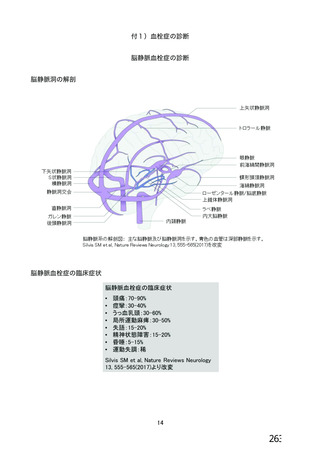
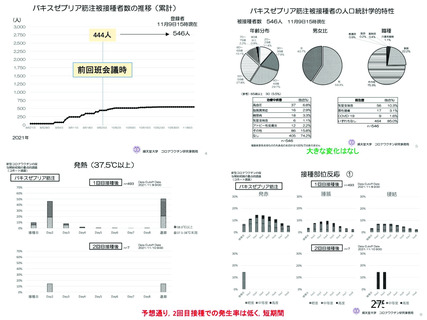
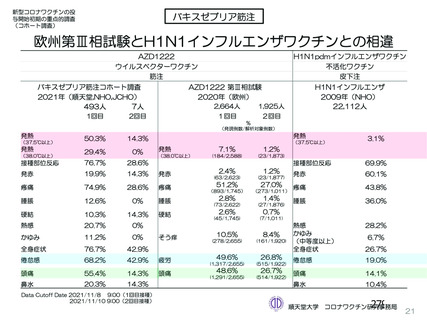
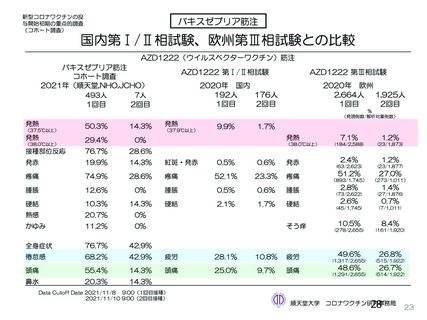
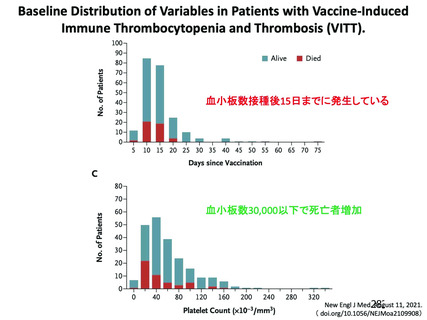
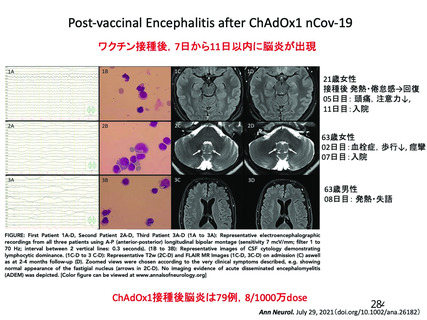
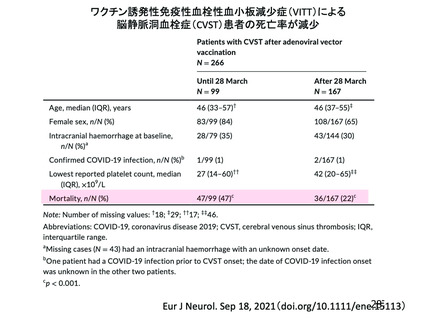
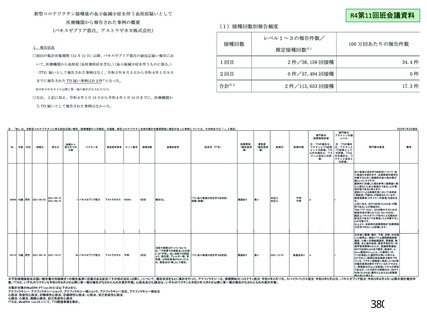
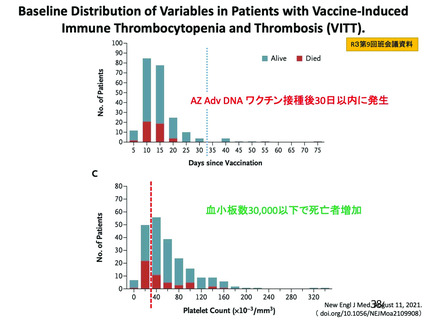
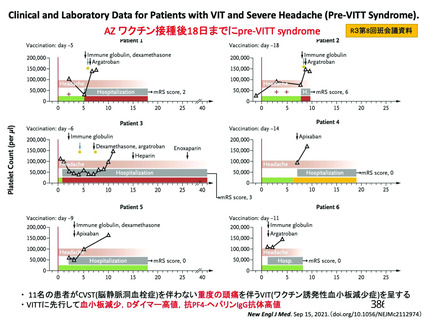
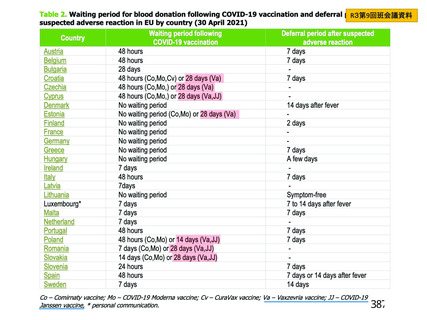
資 料4-2-➁ 令和4年度第2回安全技術調査会の審議結果について➁ (230 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
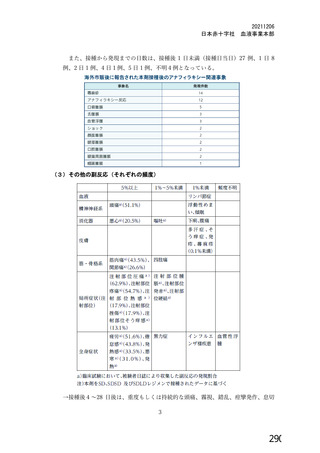
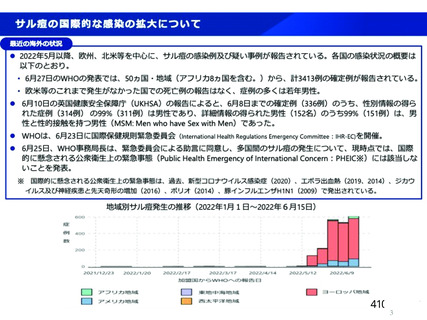
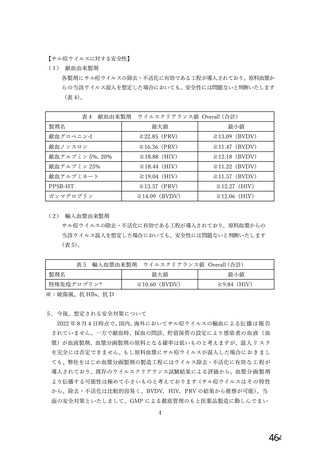
サル痩ウイルスが万が一、 原料血毅に混入した場合でも、 製造工程におけるウイルス不活
化・除去工程等はウイルス対策として有効に機能すると考えます (表1)。 文献等からウイ
ルス除去膜処理工程及び液状加熱処理工程は、 サル痩ウイルスに対して頑健性が高く、有効
な不活化・除去工程であると考えられます。
サル癒ウイルスは短径 140-260 nm、 長径 220-450 nm の大型のエンベロープウイルス
であり、製造工程に導入していぃる平均孔径 35 nm 以下のウイルス除去膜処理により効果的
に除去されると考えます。 また、 サル痩ウイルスに近紹のワクシニアウイルスを用いた実験
では、60'Cの液状加熱処理により3時間で検出限界以下まで (5 Log reduction value(LRV)
以上) 不活化されるため、液状加熱処理工程 (60'C、10 時間) も サル痩ウイルスの不活化
に有効であると考えます233。
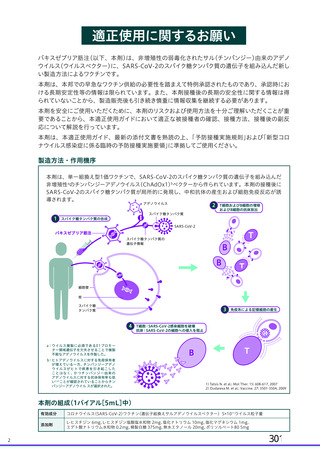
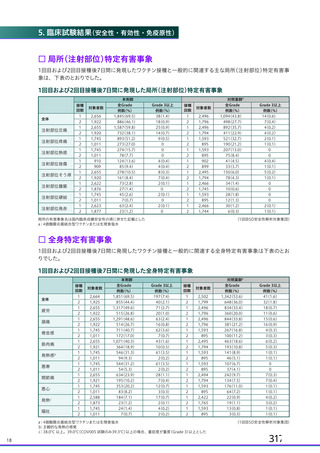
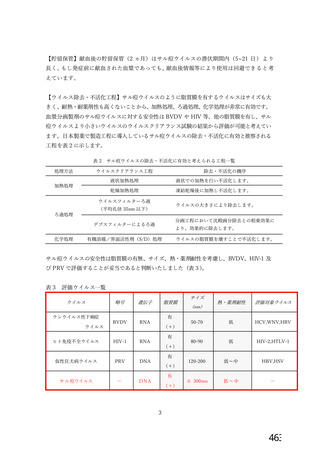
ウイルス除去膜処理工程及び液状加熱処理工程以外のウイルス不活化・除去工程につい
てゃも、脂質膜をもゃつ非特異的モデルウイルスを用いたウイルスクリアランス試験の結果か
ら、一定の効果が認められると考えます (表3 17)。
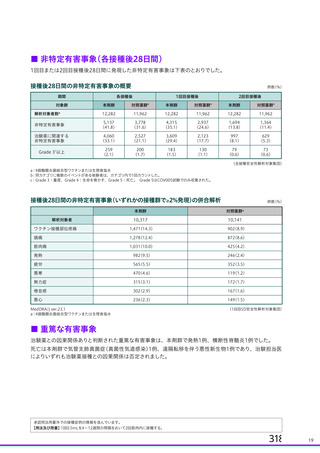
加えて、ろ過滅菌を目的として全ての血殺分画製剤の製造工程に組み込まれているろ過
滅画フィルター (0.2みm) についても、ワクシニアウイルスを用いたクリアランス試験で 4
LRV 以上の除去効果が報告されています ?。本工程は、ウイルス除去を目的とした工程で
はありませんが、サル痩ウイルスの粒子径から同ウイルスの除去は一定程度可能であると
考えられ、製剤の安全性マージンの向上に寄与すると考えます。
3. 製剤のサルウイルスに対する安全性
現在のところ、血液を介したサル痩ウイルスの伝播は報告されておらず59、また献血 (供
血) 時の間診及び貯留保管により、リスクの高い血靖の排除が可能です。さらに、 製造工程
中のウイルス不活化・除去工程、 特にウイルス除去膜処理工程及び液状加熱処理工穏は、 サ
ル痩ウイルスのリスク低減に有効と考えます。 なお、 ウイルス除去膜処理工程及び液状加熱
処理工程のいずれも製造工程に組み込まれていないコンコエイト-HT についても、S/D 処
理工程、 乾燥加熱処理工程及びろ過滅菌フィルター (0.2zm) により、サル間ウイルスに対
する安全性が確保されているものと考えます。
以上のことから、弊機構の製刑のサル療ウイルスに対する安全性は十分に担保されておぢお
り、製剤を介したサル痩ウイルス感染の可能性は極めて低いと考えます。
44(