資 料4-2-➁ 令和4年度第2回安全技術調査会の審議結果について➁ (248 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(KMバイオロジクス株式会社提出資料)
KMバイオロジクス株式会社
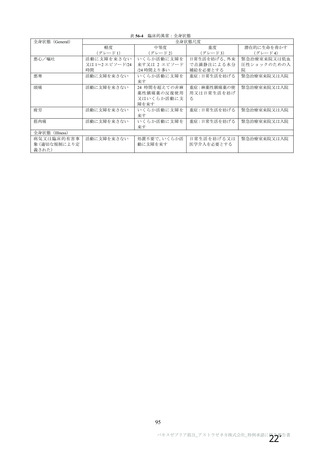
① 採血事業者での採血時癌診、貯留保管 (インベントリーホールド) 期間及び弊社の血閑受入から製
造授入までの期間を考慮した考察
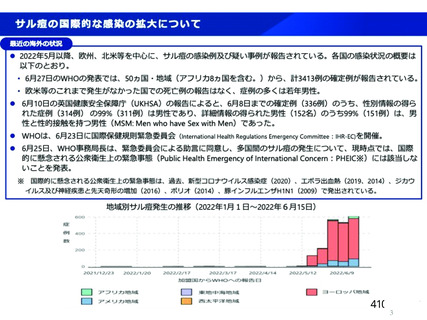
サル間ウイルスの潜伏期間は通常 6て13 日であるが、521 日となることがありえる中]。
発症後に採血される場合、潜伏期間後に発熱、頭痛、リンパ節腫須、筋肉痛などが 1^5 日続き、
その後発疹が出現するため、採血時の問診にて排除できる可能性が高い。
発症前・潜伏期間中に採箇されていた場合、採血事業者での貯留保管が 2 箇月間であること、弊
社での血立受入から製造投入までの最短期間は過去実績から 34 日間であり、採血から製造投入ま
での期間が潜伏期間よりも長いため、献血後情報によりサル癒容出者由来の血頑バックを特定で
きれば、製造投入前に排除できる。
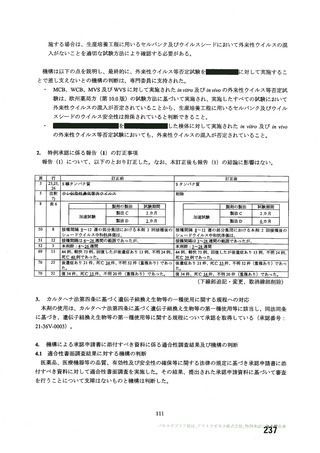
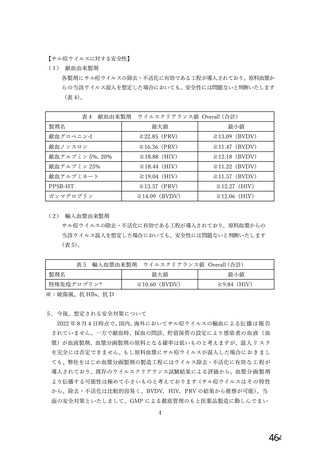
② サル間ウイルスを含む原料血呆を使用した場合の血競分画製剤の安全性について、現行の各血毅分
画製剤の製造工程におけるウイルスクリアランス試験結果等を考慮した考察
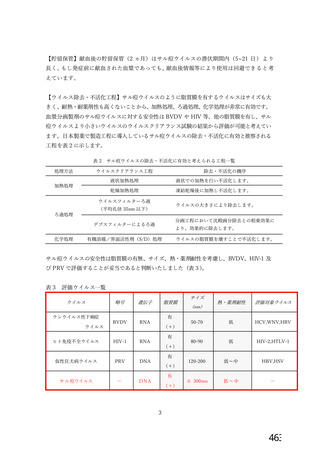
エンベロープの有無、核酸の種類等中から、サル疹ウイルスの特異的モデルウイルスには PRV
(仮性狂犬病ウイルス) が該当すると考えられる (サル間ウイルス、PRV の比較は表 1. を参
時) 。PRV を用いて、弊社で製造するすべての血立分画製剤についてウイルスクリアランス試験
を実施している (PRV を用いた各製剤・各工程のクリアランス試験結果は表 2. を参照) 。
サル癒ウイルス陽性となった血次が製造に投入された場合、各工程の PRV に対するウイルスクリ
アランス効果はサル間ウイルスに対しても同様に不活化除去効果が期待でき、「血区分画製剤の
ウイルス安全対策について (薬食審査発第 1107001 号、薬食安発第 1107001 号、薬食監発第
1107001 号、薬食血発第 1107001 号、平成 15 年 11 月 7 日) 」に定める総ウイルスクリアランス
指数 9 以上を十分確保できている。
③ サル痩ウイルスの特性 (ウイルス粒子サイズ) 及び弊社製造工程を考慮した考察
見社で製造する全ての血舌分画製剤の製造工程には平均孔径 35nm 以下のウイルス除去膜ろ過を導
入している。サル間ウイルスの大きさ (約300 nm) を考慮すると、当該ろ過によるウイルス除去
効果が期待できる。
以上のことから、弊社で製造する全ての血区分画製剤は、サル瘍ウイルスに対して一定の安全性を有
すると考える。
参考 URL
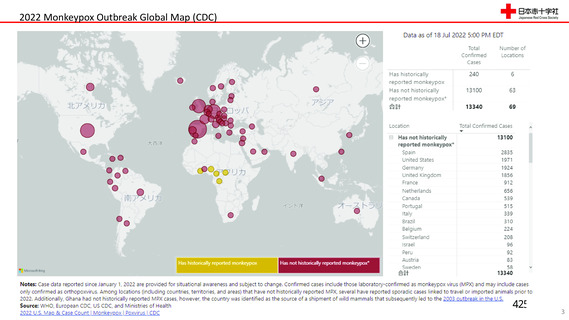
[1] WHO: https://www. who. int/en/news-room/fact-sheets/detai]1/monkeypox
[2] 国立感染症研究所: https://www.niid. go. jp/niid/ ja/kansennohanashi/408-monkeypox-
intro. html
1/3
KM バイオロジクス株式会社
40(