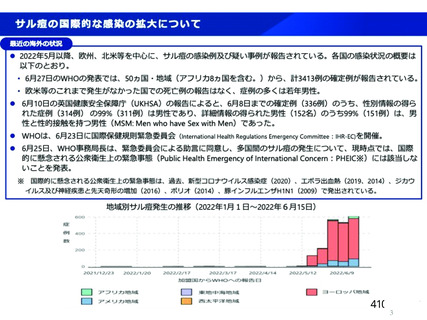
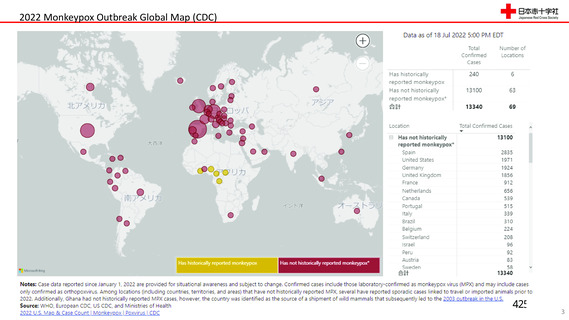
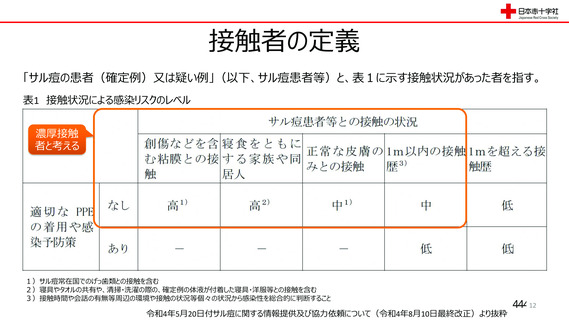
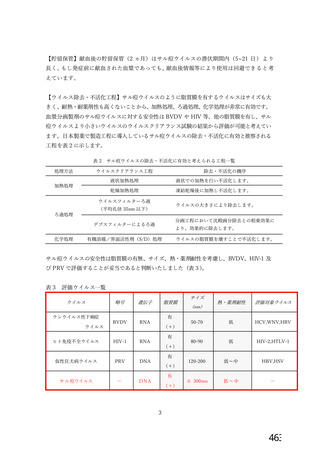
資 料4-2-➁ 令和4年度第2回安全技術調査会の審議結果について➁ (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
変更内容
(治験実施計画書版番号)
変更理由
①4 群にアセトアミノフェンの予防投与を導入 (講
版、20鐘年目有園日)
⑫4b 群追加 : 当初 42 群に組み入れられた 18$3 歳の
被験者最大 100 例に対して、2 回目接種を行う (叶
①よくみられる局所及び全身性の副反応の重症度を低減させ
るため。
⑨2 回接種の免疫原性データ を収集するため。
用法・用量 | 版、20革年邊月園B) ③④COVe01 試験 3 群の免疫原持の中間結果から、1 回接種
目 妖に2同上接種を追加 (還版、20較年上| こ計計して2回接福で中和拓体価が改善することが示された
④1a、2a 及び 3a 群に対し 2 回目接種を追加 (加計 ため。
版、20較年時B)
①COV001 試験に用いた人製剤との比較のため。
①$ 群の追加 (還版、20年月園日) ⑨LDSD の接種を受けた 4 群の組入れを終了し、有効性評価
②4 群に組み入れる披験者数を減少 (較版、20年有 | のために SDsD を接種する 6 群を設定するため。
月目昌) ③異なる製造所の製剤を比較するため。
③6 群の追加 (較版、20咽年上月目日) ④異なる製造所の製剤を評価し (3 群) 、高齢者群のデータ
④⑧S5a、b 及びc群、7a 及びb群、並びに sa及びb群 を収集、並びに 1 及び2 群と同様の試験デザがインとするため
の追加 (較版、20久年月園) (7及び8群) 。
⑧5d群 (園 持の製割に関するロット比較群) を追 | ⑤追加した製造所の製剤について比較するため。
接種群 加 (較版、20鐘年月軒日) ⑥36 歳以上の被験者の有効性を評価するため。
⑥9 及び10群 (56歳以上の被験者の有効性評価群) ⑦ChAqdOx1 ベクターワクチンの接種を過去に受けた被験者
を追加 (較版、20鐘年月較昌) における安全性及び免疫原性を検討するため。
②11 群の追加 (較 版、20較年有有半日) ⑧HIV 感染者における安全性及び免疫原性を検討するた
⑧12 群 (HTV 陽性の被験者) を追加 (較講版、20較 | ぁ。
年邊月 時日) ⑨小児グループにおける安全性及び免疫原性は別の治験実施
⑨3 群の削除 (較証皮、 20較年還月目) 計画書で評価するため。
⑩3e 及び Sf 群の追加 (較証版、20較年較月当日) ⑩異なるレジメンにおける Semm Imstitute of mdia が製造し
た製剤とのロット比較のため。
①3.000 例から最大 10260 例に増加 (罰版、20較年上 | ①ワクチン製造所間の違いを評価するためのロット比較の ?
月較昌) 群の追加。 当初の予定より多く治験薬を確保できたため、4
@被験者数を最大 10560 例まで増加 (較皮、20久年 | 群の被験者数を増加。
較有) ②異なる用硬測定法の問の副反応及び免疫原性を比較するた
症例数 全体の被験者数を 12330 例に増加 (較上、20較年 | めの新たなロット比較群及び高齢者群を追加。
月較) 新たなワクチン製造所の追加に伴い、新たなロット比較群
④9 及び10 群の組入れ数をそれぞれ 1000 例士10%と を追加、及び 36 歳以上の被験者の有効性評価群を追加。
する。 全体の被験者数は変更なし (半証版、20較年 | ④複数施設で組入れ活動を行っていること、並びに過剰組入
園朋B) れの可能性があることを考慮した。
①4 及び6 群の組入れ年齢上限を 36 歳未満に引き下げ
(較皮、20較年月園B) ①56 歳以上の被験者は 9 及び 10 群に組み入れらちれることに
選択基準 ②9、10 及び fi 群は、過去に PCR 陽性であった被験 | なったため。
者の組入れが可能であることを明確化 (較講版、20詳 | ②組入れ基準を明確にするため。
年 較)
①組入れ前に SARS-CoV-2 に対する血清反応陽性の被
を肖 和
腺外を削除。 (還版、20較年月園) 開 上5 コー
2 失笑に関する除名を加し、補人 の5にき0た記事誠信和折
除外基準 | の被験者の安全性又は試験結果の解釈に影響を及ぼす - ー
可能性がある有害事象、4 週間以内 (定状がある場 の②撤者の安全友和時果の名能作を確保するた
合) 又は2 週間以内 (無症状の場合) に SARS-CoV-2 *
の ECR 検査陽性を除外対象に加えた。 (較計版、
20鐘年有朋目B)
①ぬぐい検体検査のトリガーに喫覚味覚の消失を追 | ①疑い症例が、確実に検査、判定の対象となることを目的と
加 (較皮、20較年有朋較B) し、COVID-19 の症状に関する情報の更新に対応した症状の
⑨COVID-19 と診断された診察から 7 日後に必要と考 | 基準へと改訂した。吊覚プ味覚の消失は、世界的流行の発生
えられる場合、又は初回の検査で陰性であった場合に | から数カ月後にCOVID-19 の症状として報告され、2020 年 4
のみ、鼻腔咽頭のぬぐい検体検査を実施する。 (較 | 月 17 に、CDC はウイルス明釧後 2ー14 日後に現れる可能
版、20詳年月園有) 性のある症状一覧に「新規の味覚あるいは喫覚の消失」を追
主要評価項目 | ③ぬぐい検体検査に関して変更 (COVID-19 が疑われ | 加した。2020 年3月4日、WHO はウェブサイトの Qg&A の
る症状を発現した被験者が初回の受診で陰性の場合に
在宅検査を追加、2 回目のぬぐい検体採取のための初
回受診日から 3-3 日後に行われる受診を追カ) (回還
版、20較年明月目日)
④⑧エンドポイントの定義を目的として、診断PCR を
核酸増幅検査に変更 (較講皮、20較年還月当日)
COVID-19 症状リストに「味覚あるいは只覚の消失」を追加
した。
②③症例を最大限特定するため。
④PCR 法ではない SARS-CoV-2 診断検査 (Transcription
Mediated Amplificaion [TMA] 法等) を含めるため、広義の
用語を使用。
97
223