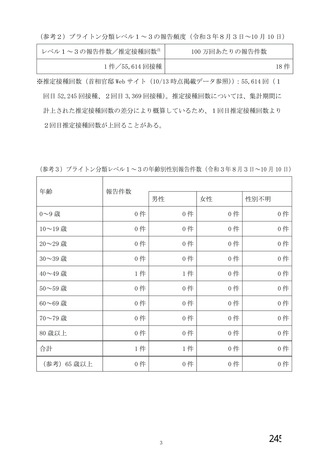
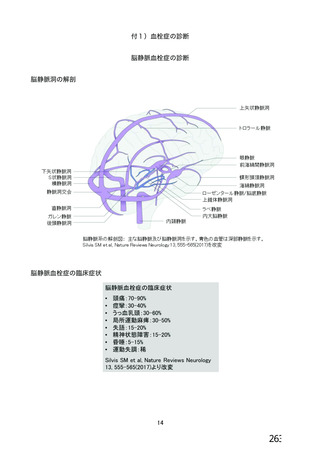
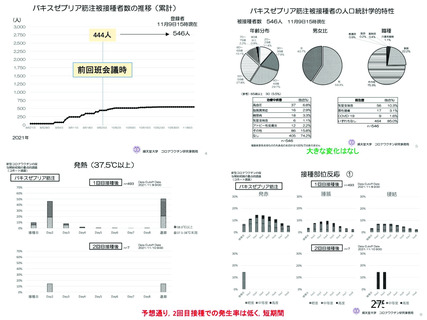
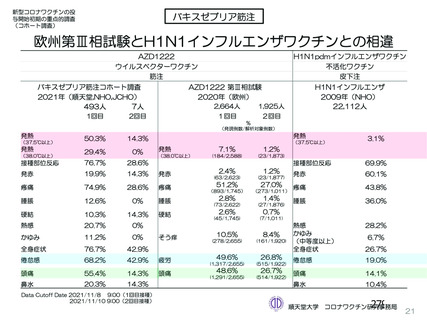
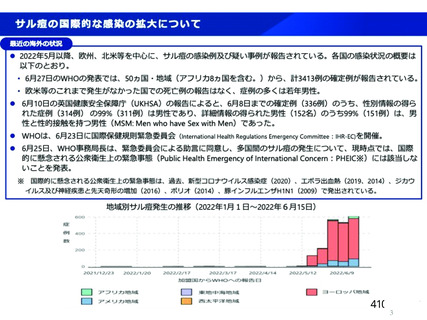
資 料4-2-➁ 令和4年度第2回安全技術調査会の審議結果について➁ (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
変更内容 。
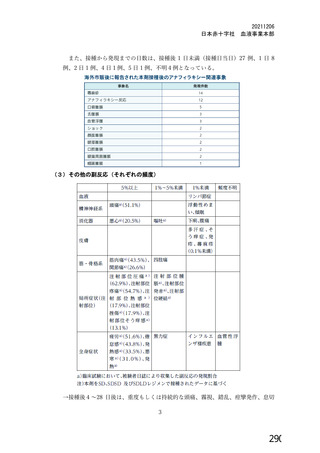
(治験実施計画午上番号 委更理由
、 COV001 試験 3 群の免疫原性の中間結果から、1 回
用法・用明 四 1d群の 2 回日接種和を追加 (軒版、20年明月 | 生和と比較して 2 回接種で中和和抗体価がek午するこ
とが示されたため。
2最大 10000 暫まで間 (較還の0菩間し 用び聞説の追吉、太び2 回接種を
症例数 ら最大 10000 例まで増加 (較版、20調年月較日 トー Aaュー
②最大 10300 例まで増加 (較版、2 上 日) 章時 ける競合的かつ同時に被験者組入
妊娠の転帰が中絶又は流産である場合、2 回目の接種を受
選択基準 | けることができることを明確化 (較版、20較年月閣 | 組入れ基準を明確にするため。
日)
①組入れ前の COVID-19 血清反応陰性の規定を削除 (較
版、20較年目月 園)
②COVD-19 の既往歴は、血清学的検査又は PCR での確 Q①FDA ガイドラインでは、感染歴のある者でのベネ
認可能であることを明確化。 (還版、20較年月罰 フィット・リスクを評価することの重要性から有既感
日) 染例を除外しないことを推奨している。また、検査
2 回目接種に関する除外基準を追加 し、初回接種後の被 | 機関の流通上の制約から血清学的検査の結果が予定
除外基準 験者の安全性又は試験結果の解釈に影響を及ぼす可能性が | どおり提供できないため。
ある有害事旬、4 週間以内 (症状がある場合) 又は 2 週間 | ⑧組入れ基準を明確にするため。
以内 (無症状の場合) に SARS-CoV-2 の PCR 検査陽性を | ③被験者の安全性及び治験結果の解釈可能性を確保
除外対象に加えた。 (還版、20久年月半日) するため。
④COVID-19 の既往歴の確認は、抗原や抗体に基づく迅速 | ④組入れ基準を明確にするため。
検査でも可能であることを明確化 (較版、20較年目月園
日)
表60 COV005 試験の治験実施計画書第 較版 (20較年目月較日付け) までの主要な改訂内容
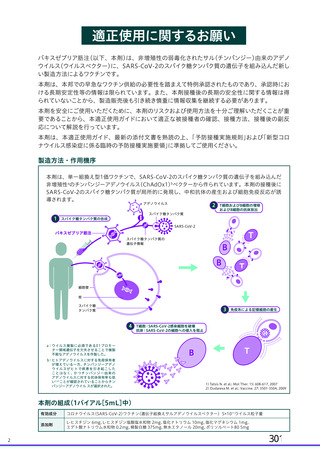
突更内傘 変更理由
(治験実施計画書版番号)
_ ①英国の COV001 試験の計画に合わせるため。
、> っ ン 会は、 試験における安 性の
用法・用量 ョ5 ジュールに変更 (較版、20較年上 計休条を受けて、本計で2四柱を客することを失
ざ撤験者が2 国日接種前に COVID-19 又は舞症任 ③了臨床的に安定しており、COVID-19 からの十分な回復が示
の SARS-CoV-? 感菜を発症した場合の 2 回目接種の | てしと場合にのみ 2 回目接種が行われることを担保するた
時期について明確化 (較版、20軒年有朋園日) 5 ーー -
①2 群の被験者数を 530 例から 2130 例増加し 2700 ①SARS-CoV-2 感染の勢いが予測不可能であること及び
例 (合計 2800 例) とした。 (還版、20軒年四月朋 | COV001 試験における COVID-19 発症率が予想より低かった
日) ことを受け被験者数を増加。
②合計被験者数を 2800 例から 2000 例に減少 (2a ②プラセボ群の発症率を 2.59%にから 3.5%として被験者数を
群 : 530 例から 230 例に変更、2b 群 : 2150 例からち 再算出した。
下例雪 1.630 例に変更) (較版、20計年目月 較日) ③安全性コホートにおいて適切な評価可能例数を確保するた
③1 群の被験者数を 50 例から 70 例に増加、これに | め。最初の 24 例のうち6 例が組入れ時の鼻スワブで SARS-
より全体の被験者数を 2000 例から 2020 例に増加 CoV-2 陽性と判定され、評価可能でない被験者の割合が想定
(較皮、20較年有朋較) より高かった。
④3 群の被験者数を 50 例から 100 例に増加。これに | ④約 13 が SARS-CoV-2 に対する血清反応陽性例と判定され
より全体の被験者数は 2070 例に増加 (較版、20較 | ると予想されるため、被験者数を 100 例とすることで、約
年月 園) 30 例の血清反応陰性例が確保できる。
以下の臨床倫理委員会の勧告に沿った : 併発疾患の有病率は
選択基準 被験者の年齢上限を 55 歳から 65 歳以下に引き上げ | 年齢の増加に伴い増加するが、33 歳以上のすべての成人が
(較版、20計年朋月目日) 脆弱なわけではなく、選択基準を満たし、除外基準に抵触し
ない場合、本治験に参加する機会を与えるべきである。
①集団が不均一となり免疫原性評価に対する影響を避けるた
①COVTD-19 の既往歴又は現病のある者を除外基準 | めに現在又は過去の感染例を除外する。
に追加 (較版、20六年月較) ②FDA ガイドラインでは、過去の感染に関するスクリーニ
除外基準 ②過去に感染があった被験者を除外するためのスク | ングを実施しないことが提案されている。また、感染歴のあ
リーニング来院時の COVTD-19 の血清学的検査を削 | る集団でのベネフィット・リスクを評価する必要性がある。
除 (較版、20較年月園日) さらに、検査機関における流通上の問題により、血清学検査
結果を適時提供することが難しかった。
主要有効性評価項目を「2 回目の接種後 15 日以降に 昌 _
主要評価項目 | 発現したCOVID-19」と定義 (較版、20較年邊月 免疫原料の政善 (COV001 試験データ) に基づく 2 回接種ス
較B)
ケジュールの採用決定に伴い変更。
98
224