資 料4-2-➁ 令和4年度第2回安全技術調査会の審議結果について➁ (246 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
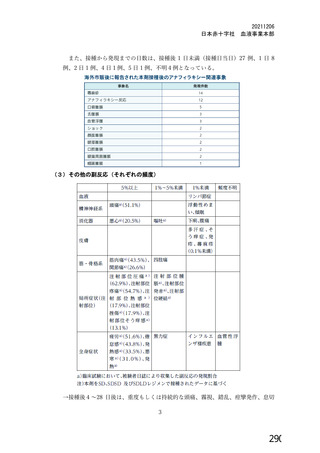
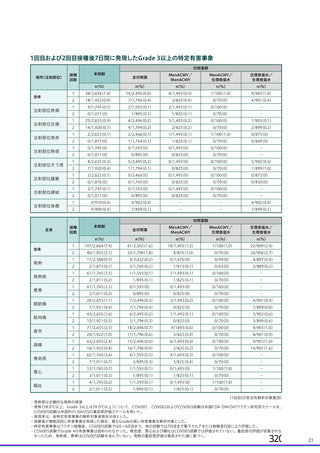
(1) 献血由来製剤
各製剤にサル痘ウイルスの除去・不活化に有効である工程が導入されており、原料血漿か
らの当該ウイルス混入を想定した場合においても、安全性には問題ないと判断いたします
(表 4)。
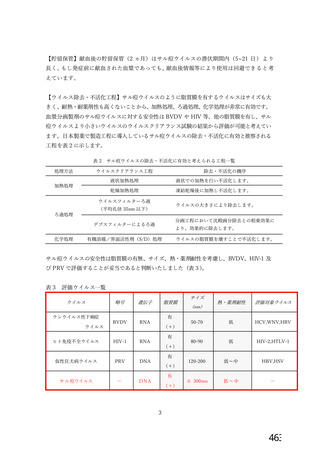
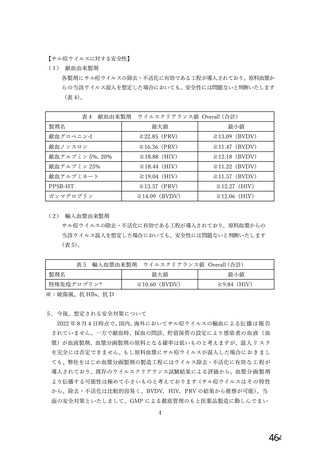
表4
ウイルスクリアランス値 Overall (合計)
献血由来製剤
製剤名
最大値
最小値
献血グロベニン-I
≧22.85(PRV)
≧13.09(BVDV)
献血ノンスロン
≧16.36(PRV)
≧11.47(BVDV)
献血アルブミン 5%, 20%
≧18.88(HIV)
≧12.18(BVDV)
献血アルブミン 25%
≧18.44(HIV)
≧11.22(BVDV)
献血アルブミネート
≧19.04(HIV)
≧11.57(BVDV)
PPSB-HT
≧13.37(PRV)
≧12.27(HIV)
≧14.09(BVDV)
≧12.06(HIV)
ガンマグロブリン
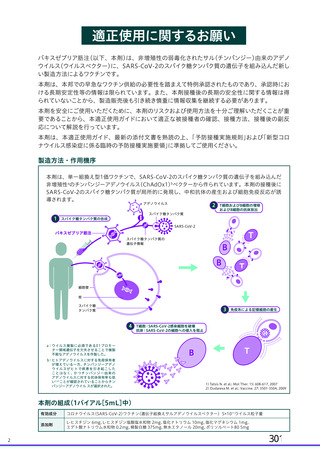
(2) 輸入血漿由来製剤
サル痘ウイルスの除去・不活化に有効である工程が導入されており、原料血漿からの
当該ウイルス混入を想定した場合においても、安全性には問題ないと判断いたします
(表 5)。
表5
輸入血漿由来製剤
ウイルスクリアランス値 Overall (合計)
製剤名
特殊免疫グロブリン※
最大値
最小値
≧10.60(BVDV)
≧9.84(HIV)
※:破傷風、抗 HBs、抗 D
5.今後、想定される安全対策について
2022 年8月4日時点で、国内、海外においてサル痘ウイルスの輸血による伝播は報 告
されていません。一方で献血時、採血の問診、貯留保管の設定により感染者の血液(血
漿)が血液製剤、血漿分画製剤の原料となる確率は低いものと考えますが、混入リ スク
を完全には否定できません。もし原料血漿にサル痘ウイルスが混入した場合におきまし
ても、弊社をはじめ血漿分画製剤の製造工程にはウイルス除去・不活化に有効な工 程が
導入されており、既存のウイルスクリアランス試験結果による評価から、血漿分画製剤
より伝播する可能性は極めて小さいものと考えております(サル痘ウイルスはその特性
から、除去・不活化は比較的容易く、BVDV,HIV,PRV の結果から推察が可能)。当
面の安全対策といたしまして、GMP による徹底管理のもと医薬品製造に勤しんでまい
4
464