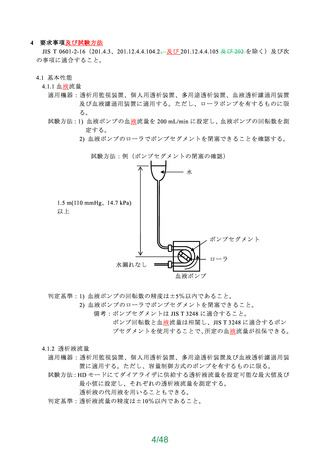
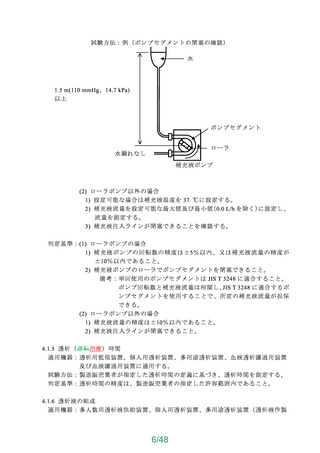
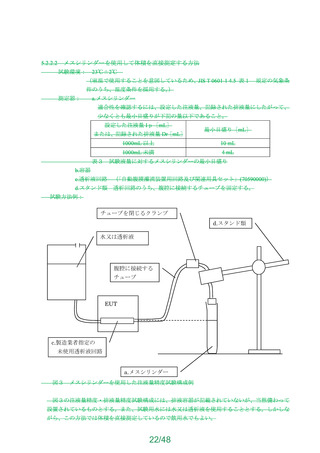
よむ、つかう、まなぶ。
【資料3】医療機器の承認基準改正案 (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33554.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和5年度第1回 6/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添
硬膜外投与用針及び脊髄くも膜下・硬膜外針承認基準(改正案)
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第 2 条第 5 項か
ら第 7 項までの規定により厚生労働大臣が指定する高度管理医療機器、管理医療機器及
び一般医療機器(平成 16 年厚生労働省告示第 298 号。以下「クラス分類告示」という。
)
別表第 1 第 359 号に規定する硬膜外投与用針及び第 360 号に規定する脊髄くも膜下・硬
膜外針について、次のとおり承認基準を定め、令和○年○月○日から適用する。
硬膜外投与用針及び脊髄くも膜下・硬膜外針承認基準
1.適用範囲
クラス分類告示に規定する、硬膜外投与用針及び脊髄くも膜下・硬膜外針とする。
2.技術基準
別紙1に適合すること。
3.使用目的又は効果
使用目的又は効果は、麻酔薬又は鎮痛薬を投与するカテーテルを硬膜外腔に留置
すること及び硬膜外腔又はくも膜下腔に麻酔薬又は鎮痛薬を投与するものであるこ
と。
ただし、くも膜下腔への麻酔薬又は鎮痛薬を投与する場合は、脊髄くも膜下・硬
膜外針に付属又は組み込んでいる麻酔脊髄用針(脊髄くも膜下麻酔針)で行うもの
であること。なお、この麻酔脊髄用針(脊髄くも膜下麻酔針)を用いてカテーテル
の留置は行なわないこと。また、この麻酔脊髄用針(脊髄くも膜下麻酔針)は単独
では流通しないものとすること。
4.基本要件への適合性
別紙2に示す基本要件適合性チェックリストに基づき 基本要件への適合性を説明
するものであること。
5.その他
構造、使用方法、性能等が既存の医療機器と明らかに異なる場合については、本
基準に適合しないものとする。
27/48
硬膜外投与用針及び脊髄くも膜下・硬膜外針承認基準(改正案)
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第 2 条第 5 項か
ら第 7 項までの規定により厚生労働大臣が指定する高度管理医療機器、管理医療機器及
び一般医療機器(平成 16 年厚生労働省告示第 298 号。以下「クラス分類告示」という。
)
別表第 1 第 359 号に規定する硬膜外投与用針及び第 360 号に規定する脊髄くも膜下・硬
膜外針について、次のとおり承認基準を定め、令和○年○月○日から適用する。
硬膜外投与用針及び脊髄くも膜下・硬膜外針承認基準
1.適用範囲
クラス分類告示に規定する、硬膜外投与用針及び脊髄くも膜下・硬膜外針とする。
2.技術基準
別紙1に適合すること。
3.使用目的又は効果
使用目的又は効果は、麻酔薬又は鎮痛薬を投与するカテーテルを硬膜外腔に留置
すること及び硬膜外腔又はくも膜下腔に麻酔薬又は鎮痛薬を投与するものであるこ
と。
ただし、くも膜下腔への麻酔薬又は鎮痛薬を投与する場合は、脊髄くも膜下・硬
膜外針に付属又は組み込んでいる麻酔脊髄用針(脊髄くも膜下麻酔針)で行うもの
であること。なお、この麻酔脊髄用針(脊髄くも膜下麻酔針)を用いてカテーテル
の留置は行なわないこと。また、この麻酔脊髄用針(脊髄くも膜下麻酔針)は単独
では流通しないものとすること。
4.基本要件への適合性
別紙2に示す基本要件適合性チェックリストに基づき 基本要件への適合性を説明
するものであること。
5.その他
構造、使用方法、性能等が既存の医療機器と明らかに異なる場合については、本
基準に適合しないものとする。
27/48