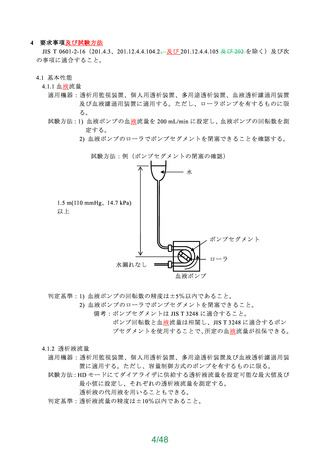
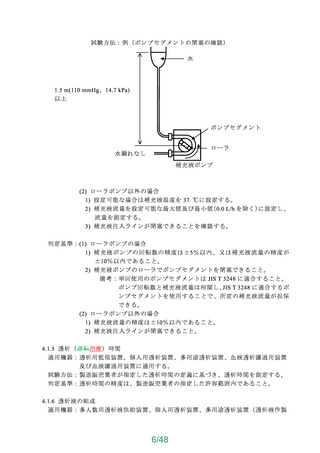
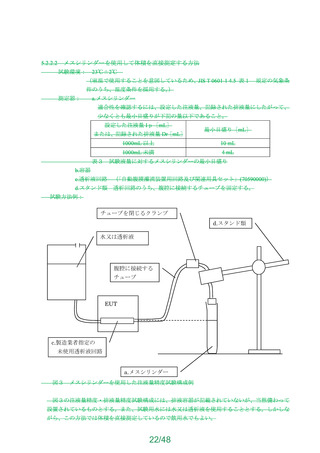
よむ、つかう、まなぶ。
【資料3】医療機器の承認基準改正案 (48 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33554.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和5年度第1回 6/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
JIS T 3231(人工心肺回路用 貯血槽)の 54.2「物理的特性」及び 54.3「性能特性」は、
以下に示した事項を満たすこと。
a)物理的特性(ソフトバッグ静脈血リザーバ及びシールドハードシェルリザーバの血液
経路の耐圧性)
・既承認・認証品 目 の規定値の 1.51.5倍の圧に耐えること。
・陽圧開放弁を設置するなど、陽圧がかからない構造となっている貯血槽においては、
その旨を説明すること。
b)性能(ボリューム表示、気泡除去性能、消泡特性)
・ボリューム表示:貯血槽に目盛りが施されていること。
・気泡除去性能及び消泡特性:空気を混入した血液を試験液とし、製造販売業者が規定
した最大流量で 60 分間循環させ、泡立てた血液が貯血槽よりあふれ出ないこと。
4.67.2 構成部品(適用される場合)
構成部品を有するものについては、次の耐圧試験及び接続性試験に適合すること。
a)耐圧試験
構成部品を人工肺に組み付けた状態で、最 高 大使用圧力の 1.5 倍の圧力にて 66 時
間保持し、構成部品自体及び構成部品と人工肺の接続部から漏れが無いこと。
b)接続性試験
構成部品と人工肺の接続部は、15 N の引張強度をかけるとき、15 秒間 以上 はずれな
いこと。
附属書(参考)
参考規格
・ ISO 7199:1996 , Cardiovascular implants and
artificial organs
–
Blood-gas
exchanger(oxygenators)
・ ISO 15674:2001 , Cardiovascular implants and artificial organs – Hard-shell
cardiotomy/venous reservoir systems(with/without filter)and soft venous reservoir bags
・ JIS T 0993-1 医療機器の生物学的評価-第 1 部:評価及び試験
・ JIS T 14971 医療機器-リスクマネジメントの医療機器への適用
・ ISO 10993-11 Biological evaluation of medical devices - Part 11: Tests for systemic
toxicity
・ 平成 15 年 2 月 13 日付け医薬審発第 0213001 号「医療用具の製造(輸入)承認申請に必要な生
物学的安全性試験の基本的考え方について(以下「生物学的安全性試験の基本的考え方」と
いう。
)
・ 平成 17 年 3 月 30 日付け薬食監麻発第 0330001 号「薬事法及び採血及び供血あつせん業取締
法の一部を改正する法律の施行に伴う医薬品、医療機器等の製造管理及び品質管理(GMP
/QMS)に係る省令及び告示の制定及び改廃について」第 4 章 第 4 滅菌バリデーション基
準(以下「滅菌バリデーション基準」という。
)
・ 平成 10 年 3 月 31 日付け医薬審第 353 号「エチレンオキサイドガス滅菌における残留ガス濃
47/48
以下に示した事項を満たすこと。
a)物理的特性(ソフトバッグ静脈血リザーバ及びシールドハードシェルリザーバの血液
経路の耐圧性)
・既承認・認証品 目 の規定値の 1.51.5倍の圧に耐えること。
・陽圧開放弁を設置するなど、陽圧がかからない構造となっている貯血槽においては、
その旨を説明すること。
b)性能(ボリューム表示、気泡除去性能、消泡特性)
・ボリューム表示:貯血槽に目盛りが施されていること。
・気泡除去性能及び消泡特性:空気を混入した血液を試験液とし、製造販売業者が規定
した最大流量で 60 分間循環させ、泡立てた血液が貯血槽よりあふれ出ないこと。
4.67.2 構成部品(適用される場合)
構成部品を有するものについては、次の耐圧試験及び接続性試験に適合すること。
a)耐圧試験
構成部品を人工肺に組み付けた状態で、最 高 大使用圧力の 1.5 倍の圧力にて 66 時
間保持し、構成部品自体及び構成部品と人工肺の接続部から漏れが無いこと。
b)接続性試験
構成部品と人工肺の接続部は、15 N の引張強度をかけるとき、15 秒間 以上 はずれな
いこと。
附属書(参考)
参考規格
・ ISO 7199:1996 , Cardiovascular implants and
artificial organs
–
Blood-gas
exchanger(oxygenators)
・ ISO 15674:2001 , Cardiovascular implants and artificial organs – Hard-shell
cardiotomy/venous reservoir systems(with/without filter)and soft venous reservoir bags
・ JIS T 0993-1 医療機器の生物学的評価-第 1 部:評価及び試験
・ JIS T 14971 医療機器-リスクマネジメントの医療機器への適用
・ ISO 10993-11 Biological evaluation of medical devices - Part 11: Tests for systemic
toxicity
・ 平成 15 年 2 月 13 日付け医薬審発第 0213001 号「医療用具の製造(輸入)承認申請に必要な生
物学的安全性試験の基本的考え方について(以下「生物学的安全性試験の基本的考え方」と
いう。
)
・ 平成 17 年 3 月 30 日付け薬食監麻発第 0330001 号「薬事法及び採血及び供血あつせん業取締
法の一部を改正する法律の施行に伴う医薬品、医療機器等の製造管理及び品質管理(GMP
/QMS)に係る省令及び告示の制定及び改廃について」第 4 章 第 4 滅菌バリデーション基
準(以下「滅菌バリデーション基準」という。
)
・ 平成 10 年 3 月 31 日付け医薬審第 353 号「エチレンオキサイドガス滅菌における残留ガス濃
47/48