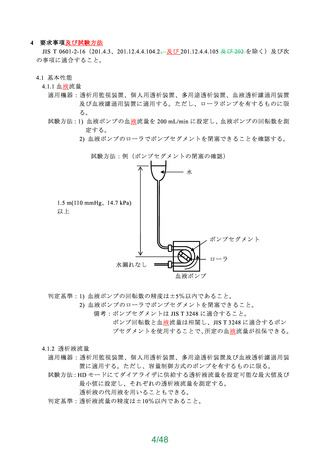
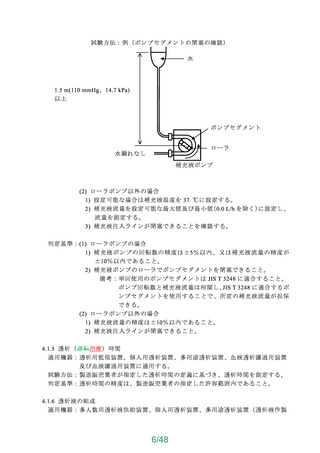
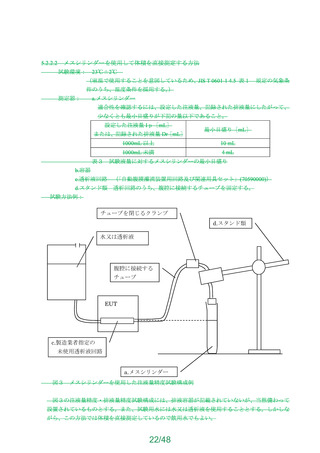
よむ、つかう、まなぶ。
【資料3】医療機器の承認基準改正案 (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33554.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和5年度第1回 6/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添
麻酔脊髄用針承認基準(改正案)
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第 2 条第 5 項か
ら第 7 項までの規定により厚生労働大臣が指定する高度管理医療機器、管理医療機器及
び一般医療機器(平成 16 年厚生労働省告示第 298 号。以下「クラス分類告示」という。
)
別表第1第 358 号に規定する麻酔脊髄用針について、次のとおり承認基準を定め、令和
○年○月○日から適用する。
麻酔脊髄用針承認基準
1.適用範囲
クラス分類告示に規定する、麻酔脊髄用針とする。
2.技術基準
別紙1に適合すること。
3.使用目的又は効果
使用目的又は効果は、脊髄くも膜下への麻酔薬又は鎮痛薬の投与及び髄液の吸
引・採取をするものであること。
4.基本要件への適合性
別紙2に示す基本要件適合性チェックリストに基づき 基本要件への適合性を説明
するものであること。
5.その他
構造、使用方法、性能等が既存の医療機器と明らかに異なる場合については、本
基準に適合しないものとする。
30/48
麻酔脊髄用針承認基準(改正案)
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第 2 条第 5 項か
ら第 7 項までの規定により厚生労働大臣が指定する高度管理医療機器、管理医療機器及
び一般医療機器(平成 16 年厚生労働省告示第 298 号。以下「クラス分類告示」という。
)
別表第1第 358 号に規定する麻酔脊髄用針について、次のとおり承認基準を定め、令和
○年○月○日から適用する。
麻酔脊髄用針承認基準
1.適用範囲
クラス分類告示に規定する、麻酔脊髄用針とする。
2.技術基準
別紙1に適合すること。
3.使用目的又は効果
使用目的又は効果は、脊髄くも膜下への麻酔薬又は鎮痛薬の投与及び髄液の吸
引・採取をするものであること。
4.基本要件への適合性
別紙2に示す基本要件適合性チェックリストに基づき 基本要件への適合性を説明
するものであること。
5.その他
構造、使用方法、性能等が既存の医療機器と明らかに異なる場合については、本
基準に適合しないものとする。
30/48