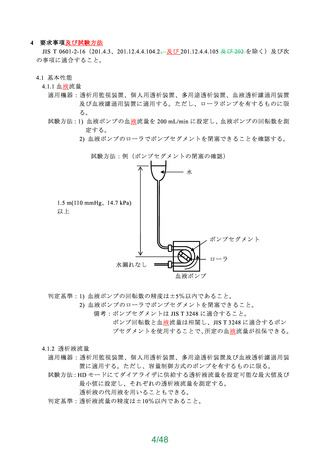
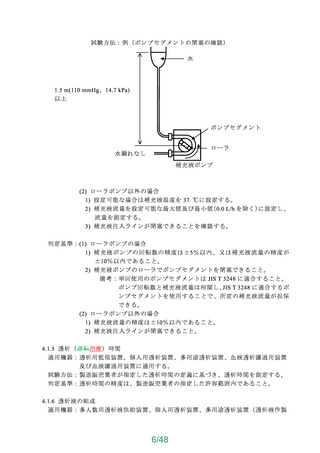
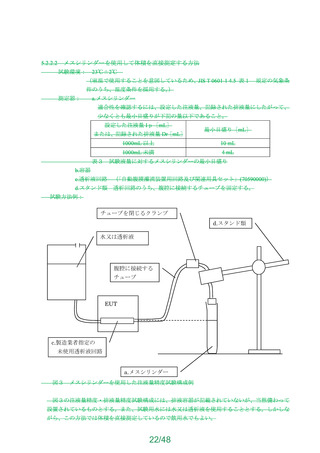
よむ、つかう、まなぶ。
【資料3】医療機器の承認基準改正案 (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33554.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和5年度第1回 6/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添
人工肺承認基準(改正案)
薬事法 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律 第 2 条の第
5 項から第 7 項までの規定により厚生労働大臣が指定する高度管理医療機器、管理医療機
器及び一般医療機器(平成 16 年厚生労働省告示第 298 号。以下「クラス分類告示」とい
う。
)別表第1第 739 号に規定する体外式膜型人工肺 及び別表第1第 740 号に規定する
ヘパリン使用体外式膜型人工肺 について、人工肺承認基準を次のように定め、平成 21
年 11 月 20 日 令和○年○月○日 から適用する。
人工肺承認基準
1.適用範囲
クラス分類告示に規定する体外式膜型人工肺 又はヘパリン使用体外式膜型人
工肺 であって、ガス交換機能 を有するもの、ガス交換機能と のほか、熱交換機
能 の両方を有するもの及び貯血槽の機能を有するもの 及び血液フィルタ機能を有
するもの に適用する。ガス交換機能について は、6 時間までの性能を担保できる
範囲に限る。
2.技術基準
別紙1に適合すること。
3.使用目的 、効能 又は効果
使用目的 、効能 又は効果は、開心術時、呼吸不全及び心肺不全の治療のため 、
に血液への酸素付加・炭酸ガスの除去を行うもの(血液の冷却・加温を行うもの
及び貯血する槽を含む)であること。
4.基本要件への適合性
別紙2に示す基本要件適合性チェックリストに基づき基本要件への適合性を説
明するものであること。
5.その他
構造、使用方法、性能等が既存の医療機器と明らかに異なる場合については、
本基準に適合しないものとすること。
39/48
人工肺承認基準(改正案)
薬事法 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律 第 2 条の第
5 項から第 7 項までの規定により厚生労働大臣が指定する高度管理医療機器、管理医療機
器及び一般医療機器(平成 16 年厚生労働省告示第 298 号。以下「クラス分類告示」とい
う。
)別表第1第 739 号に規定する体外式膜型人工肺 及び別表第1第 740 号に規定する
ヘパリン使用体外式膜型人工肺 について、人工肺承認基準を次のように定め、平成 21
年 11 月 20 日 令和○年○月○日 から適用する。
人工肺承認基準
1.適用範囲
クラス分類告示に規定する体外式膜型人工肺 又はヘパリン使用体外式膜型人
工肺 であって、ガス交換機能 を有するもの、ガス交換機能と のほか、熱交換機
能 の両方を有するもの及び貯血槽の機能を有するもの 及び血液フィルタ機能を有
するもの に適用する。ガス交換機能について は、6 時間までの性能を担保できる
範囲に限る。
2.技術基準
別紙1に適合すること。
3.使用目的 、効能 又は効果
使用目的 、効能 又は効果は、開心術時、呼吸不全及び心肺不全の治療のため 、
に血液への酸素付加・炭酸ガスの除去を行うもの(血液の冷却・加温を行うもの
及び貯血する槽を含む)であること。
4.基本要件への適合性
別紙2に示す基本要件適合性チェックリストに基づき基本要件への適合性を説
明するものであること。
5.その他
構造、使用方法、性能等が既存の医療機器と明らかに異なる場合については、
本基準に適合しないものとすること。
39/48