よむ、つかう、まなぶ。
【資料3】医療機器の承認基準改正案 (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33554.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和5年度第1回 6/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
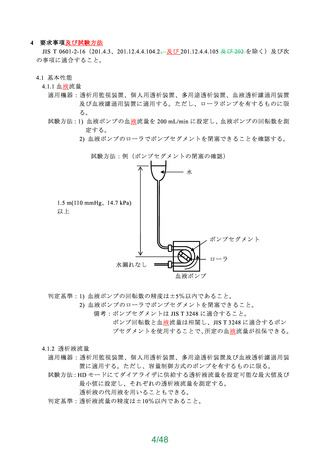
JIS T 3304 の 8「生物学的安全性」及び 9「エンドトキシン」による。
4.7 エチレンオキサイド滅菌残留物
エチレンオキサイドガスで滅菌された硬膜外投与用針及び脊髄くも膜下・硬膜外針は、JIS
T 0993-7 に適合しなければならない。
4.8 エンドトキシン
エンドトキシンについて評価を行い、安全であることを確認すること。
なお、試験による場合は 4.8.1 等を参考にすること。
4.8.1 試験方法
硬膜外針 10 本をとり、スタイレットを引き抜き、外針及びスタイレットを同じ硬質ガラ
ス容器に入れ、エンドトキシン試験用水 30 mL を加え、融封又は適切な栓で密封してよく振
り混ぜた後、室温で 1 時間放置し、この液を試験液とする。この試験液調製方法では試料全
体を試験用水に浸せき(漬)できない場合は、硬膜外針 10 本をとり、スタイレットを引き
抜き、各管内にエンドトキシン試験用水 40 mL を 1 分間約 10 mL の速さで流し、その液で
外針及びスタイレットをよく洗い、洗液を合わせて試験液とする。試験液について、日局の
エンドトキシン試験法によって試験を行ったとき、エンドトキシンの濃度は 0.5 EU/mL 未満
でなければならない。
4.89 包装
JIS T 3304 の 1110「包装」による。
5
表示
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和 35 年法律第 145
号)で求められる直接の容器等への記載事項に加え、JIS T 3304 の 1211「表示」の事項を記載
すること。
なお、ISO 594 1 又は ISO 594 2 に規定されるコネクタを有する製品との取り違い等を防止
するために、直接の容器等に「ISO 80369 6」の文字を記載する等の適切な方法により、ISO
80369 6 に適合した製品であることを識別できるようにすること。
29/48
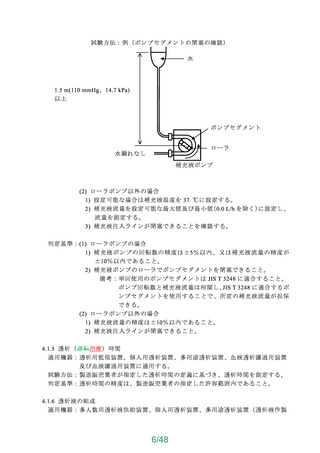
4.7 エチレンオキサイド滅菌残留物
エチレンオキサイドガスで滅菌された硬膜外投与用針及び脊髄くも膜下・硬膜外針は、JIS
T 0993-7 に適合しなければならない。
4.8 エンドトキシン
エンドトキシンについて評価を行い、安全であることを確認すること。
なお、試験による場合は 4.8.1 等を参考にすること。
4.8.1 試験方法
硬膜外針 10 本をとり、スタイレットを引き抜き、外針及びスタイレットを同じ硬質ガラ
ス容器に入れ、エンドトキシン試験用水 30 mL を加え、融封又は適切な栓で密封してよく振
り混ぜた後、室温で 1 時間放置し、この液を試験液とする。この試験液調製方法では試料全
体を試験用水に浸せき(漬)できない場合は、硬膜外針 10 本をとり、スタイレットを引き
抜き、各管内にエンドトキシン試験用水 40 mL を 1 分間約 10 mL の速さで流し、その液で
外針及びスタイレットをよく洗い、洗液を合わせて試験液とする。試験液について、日局の
エンドトキシン試験法によって試験を行ったとき、エンドトキシンの濃度は 0.5 EU/mL 未満
でなければならない。
4.89 包装
JIS T 3304 の 1110「包装」による。
5
表示
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和 35 年法律第 145
号)で求められる直接の容器等への記載事項に加え、JIS T 3304 の 1211「表示」の事項を記載
すること。
なお、ISO 594 1 又は ISO 594 2 に規定されるコネクタを有する製品との取り違い等を防止
するために、直接の容器等に「ISO 80369 6」の文字を記載する等の適切な方法により、ISO
80369 6 に適合した製品であることを識別できるようにすること。
29/48