よむ、つかう、まなぶ。
参考資料1-1 TERMS(第 8 版)と TERMS(第 9 版)改訂案の対比表[2.6MB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40908.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第3回 6/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
頁
1
変更後(第 9 版改訂案)
変更前(第 8 版)
(下線部:改訂・追加箇所)
(下線部:改訂箇所、二重下線:削除箇所)
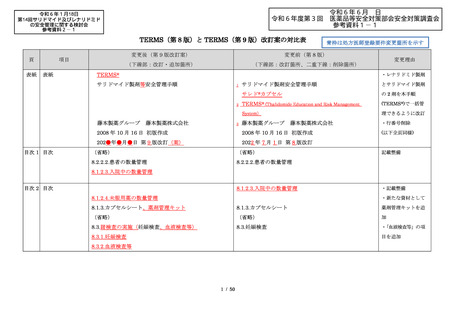
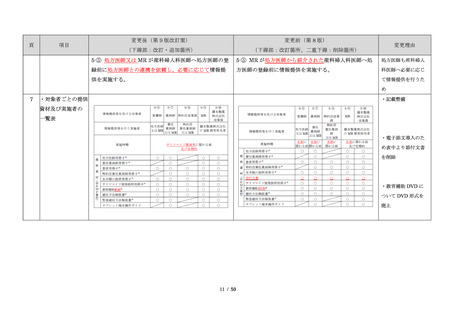
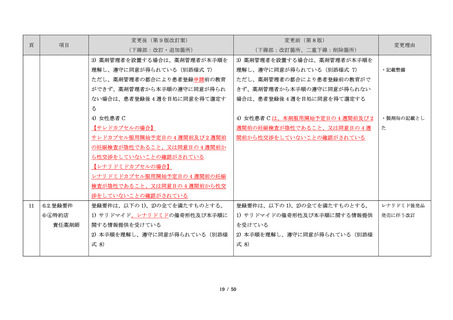
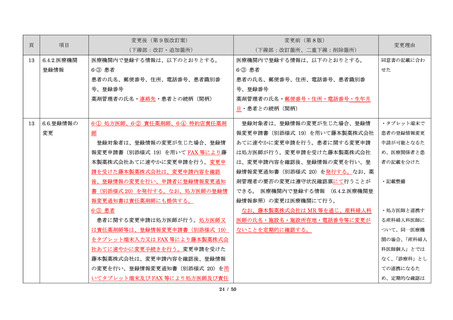
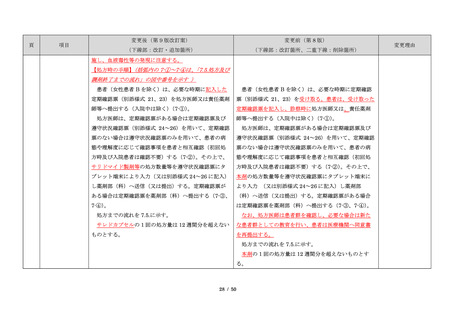
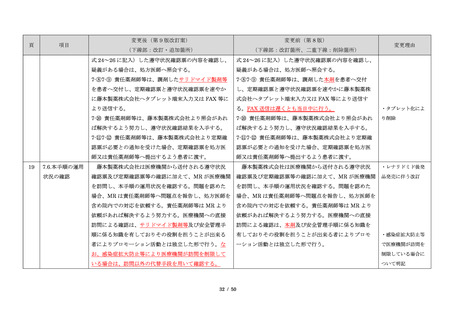
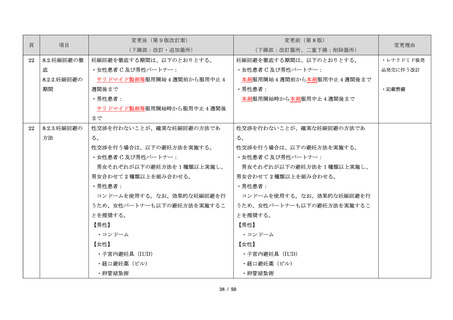
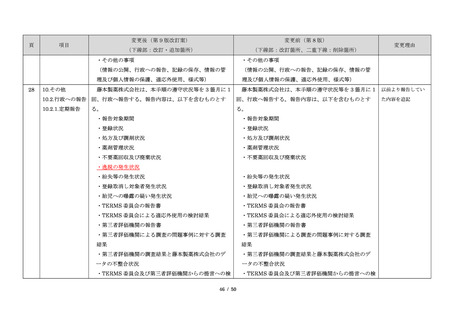
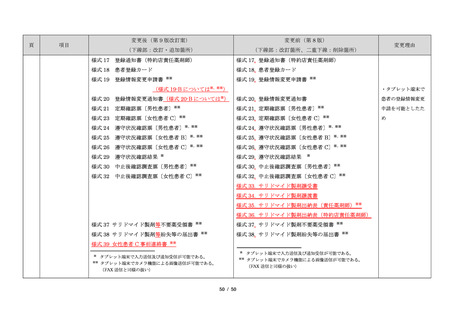
サリドマイドは、1950 年代後半に催眠鎮静薬としてド
サリドマイドは、1950 年代後半に催眠鎮静薬としてド
イツで開発された薬剤であり、本邦を含む世界各国で広
イツで開発された薬剤であり、本邦においても催眠鎮静
品発売に伴う改訂
く使用された。しかし、1960 年代初頭、サリドマイドを
薬や胃腸薬として広く使用され、また、つわり止めとし
・記載整備
妊娠中に服用した場合、胎児への重大な障害や死産を引
ても処方された。しかし、サリドマイドを妊娠中に服用
き起こすことが明らかとなり、販売の中止と回収が行わ
した場合、胎児への重大な障害や死産を引き起こすこと
れた。
が明らかとなり、販売の中止と回収が行われた。
項目
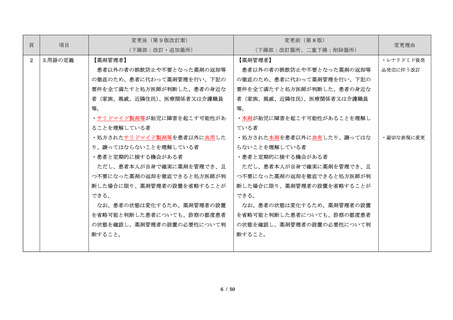
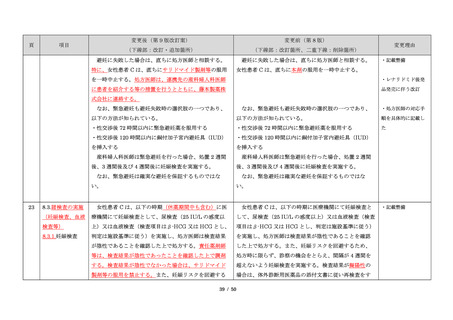
1.背景
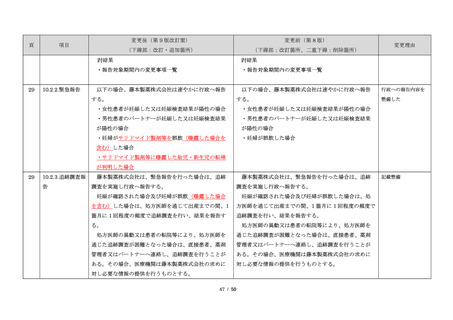
このように、サリドマイドは医薬品市場から撤退した
このように、サリドマイドは医薬品市場から撤退した
にもかかわらず、その後も薬効の研究は続けられ、1998
にもかかわらず、その後も薬効の研究は続けられ、1998
年に米国 FDA はらい性結節性紅斑を適応症として厳重な
年に米国 FDA はらい性結節性紅斑を適応症として厳重な
管理システムのもとにサリドマイドの使用を承認した。
管理システムのもとにサリドマイドの使用を承認した。
また、1999 年に多発性骨髄腫に対する有効性が米国で報
また、1999 年に多発性骨髄腫に対する有効性が米国で報
告される等、その開発が国際的に続けられ、米国をはじ
告される等、その開発が国際的に続けられている。現
め世界各国で厳格な安全管理のもとでの使用を条件に承
在、米国、オーストラリア、ニュージーランド、EU 等で
認された。
厳格な安全管理のもとでの使用を条件に承認されてい
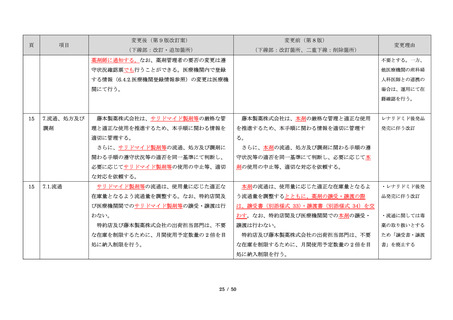
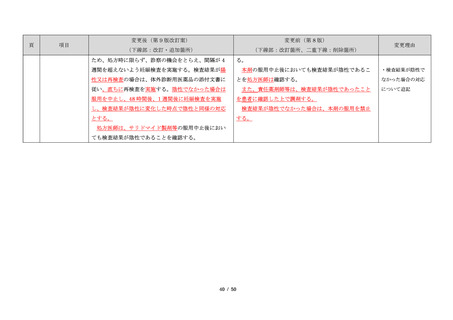
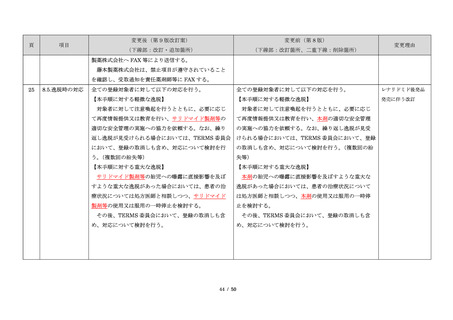
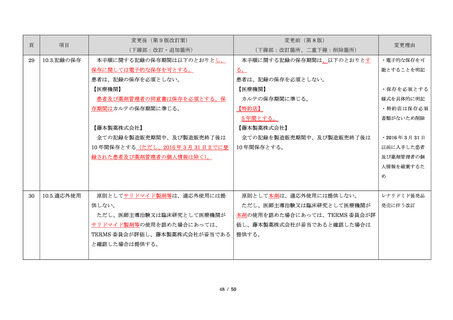
藤本製薬株式会社は、サリドマイド製剤であるサレド
る。
カプセルの製造販売承認申請にあたり、本邦の医療現場
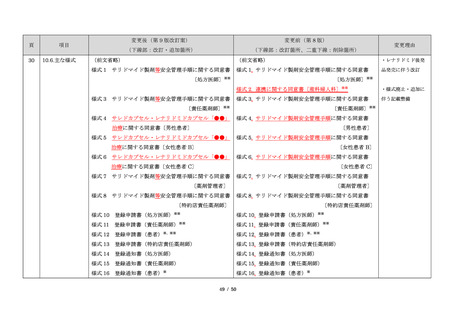
本邦では、2000 年ごろよりサリドマイドの個人輸入量
にあった安全管理手順が必要と考え、関係者の意見を伺
が増加傾向にあり、関係学会によって安全管理のための
いながら、情報提供及び教育、登録、中央一元管理、評
ガイドラインが作成され、その周知徹底が図られた。な
価を重要な構成要素とするサリドマイド製剤安全管理手
お、本邦の多発性骨髄腫患者約 14,000 人のうち 800 人程
順(TERMS®)を作成した。
度の患者が個人輸入薬により治療を受けていると推定さ
サレドカプセルが 2008 年 10 月に「再発又は難治性の
れた(サリドマイドの輸入量から算出)。また、薬監証明
多発性骨髄腫」の治療薬として承認を受けて以来、サリ
を受けて個人輸入を行っている病院等の施設は、2007 年
ドマイド製剤安全管理手順(TERMS®)の実施状況等の
度において 300 施設弱であった。
2 / 50
変更理由
・レナリドミド後発
1
変更後(第 9 版改訂案)
変更前(第 8 版)
(下線部:改訂・追加箇所)
(下線部:改訂箇所、二重下線:削除箇所)
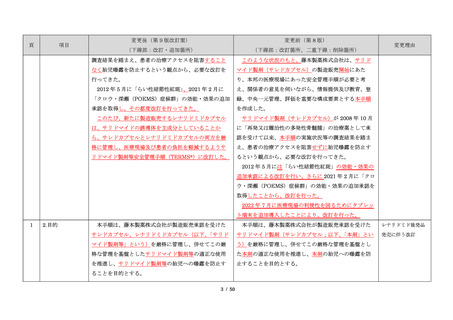
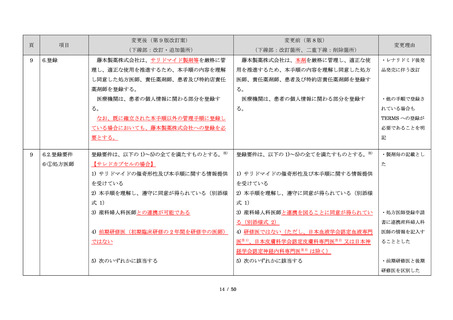
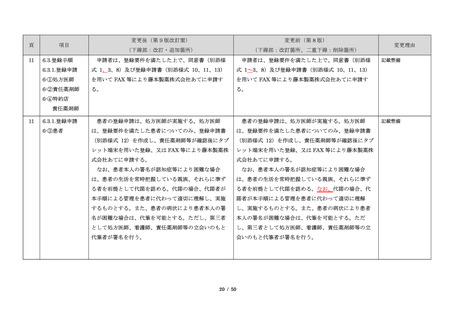
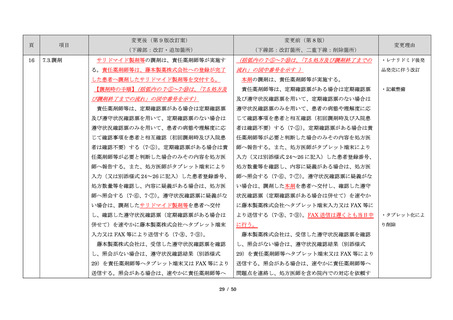
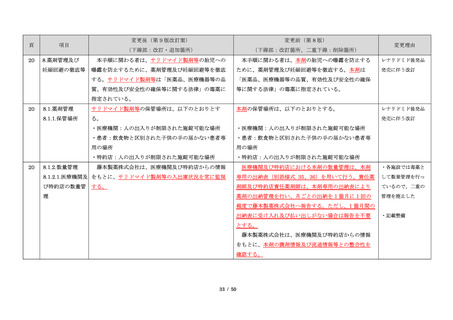
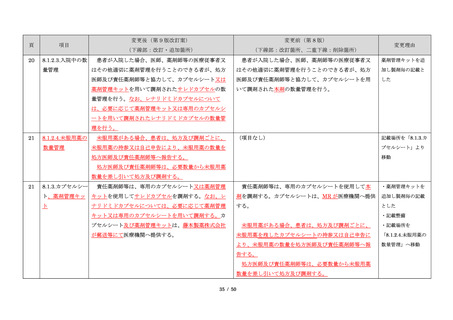
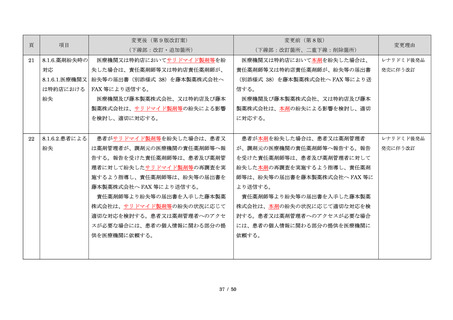
サリドマイドは、1950 年代後半に催眠鎮静薬としてド
サリドマイドは、1950 年代後半に催眠鎮静薬としてド
イツで開発された薬剤であり、本邦を含む世界各国で広
イツで開発された薬剤であり、本邦においても催眠鎮静
品発売に伴う改訂
く使用された。しかし、1960 年代初頭、サリドマイドを
薬や胃腸薬として広く使用され、また、つわり止めとし
・記載整備
妊娠中に服用した場合、胎児への重大な障害や死産を引
ても処方された。しかし、サリドマイドを妊娠中に服用
き起こすことが明らかとなり、販売の中止と回収が行わ
した場合、胎児への重大な障害や死産を引き起こすこと
れた。
が明らかとなり、販売の中止と回収が行われた。
項目
1.背景
このように、サリドマイドは医薬品市場から撤退した
このように、サリドマイドは医薬品市場から撤退した
にもかかわらず、その後も薬効の研究は続けられ、1998
にもかかわらず、その後も薬効の研究は続けられ、1998
年に米国 FDA はらい性結節性紅斑を適応症として厳重な
年に米国 FDA はらい性結節性紅斑を適応症として厳重な
管理システムのもとにサリドマイドの使用を承認した。
管理システムのもとにサリドマイドの使用を承認した。
また、1999 年に多発性骨髄腫に対する有効性が米国で報
また、1999 年に多発性骨髄腫に対する有効性が米国で報
告される等、その開発が国際的に続けられ、米国をはじ
告される等、その開発が国際的に続けられている。現
め世界各国で厳格な安全管理のもとでの使用を条件に承
在、米国、オーストラリア、ニュージーランド、EU 等で
認された。
厳格な安全管理のもとでの使用を条件に承認されてい
藤本製薬株式会社は、サリドマイド製剤であるサレド
る。
カプセルの製造販売承認申請にあたり、本邦の医療現場
本邦では、2000 年ごろよりサリドマイドの個人輸入量
にあった安全管理手順が必要と考え、関係者の意見を伺
が増加傾向にあり、関係学会によって安全管理のための
いながら、情報提供及び教育、登録、中央一元管理、評
ガイドラインが作成され、その周知徹底が図られた。な
価を重要な構成要素とするサリドマイド製剤安全管理手
お、本邦の多発性骨髄腫患者約 14,000 人のうち 800 人程
順(TERMS®)を作成した。
度の患者が個人輸入薬により治療を受けていると推定さ
サレドカプセルが 2008 年 10 月に「再発又は難治性の
れた(サリドマイドの輸入量から算出)。また、薬監証明
多発性骨髄腫」の治療薬として承認を受けて以来、サリ
を受けて個人輸入を行っている病院等の施設は、2007 年
ドマイド製剤安全管理手順(TERMS®)の実施状況等の
度において 300 施設弱であった。
2 / 50
変更理由
・レナリドミド後発