よむ、つかう、まなぶ。
参考資料1-1 TERMS(第 8 版)と TERMS(第 9 版)改訂案の対比表[2.6MB] (41 ページ)
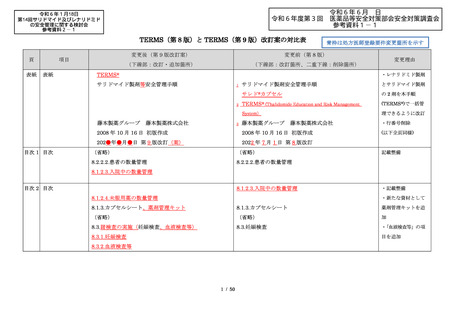
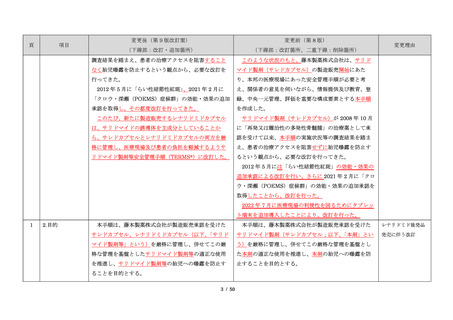
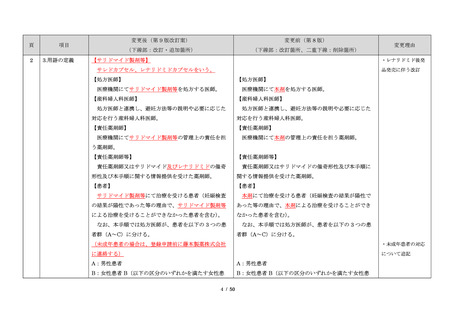
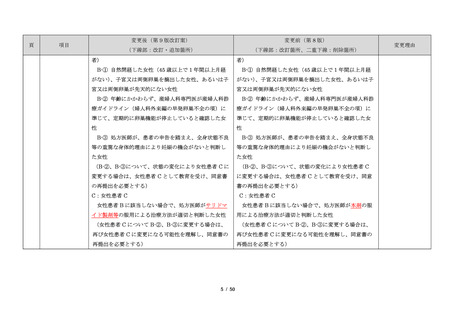
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40908.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第3回 6/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
頁
項目
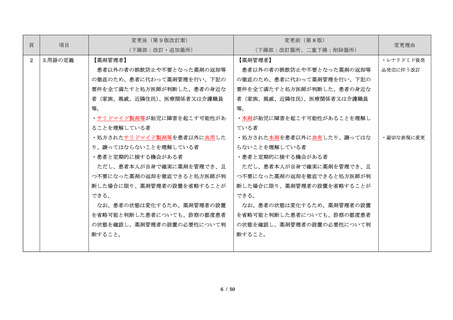
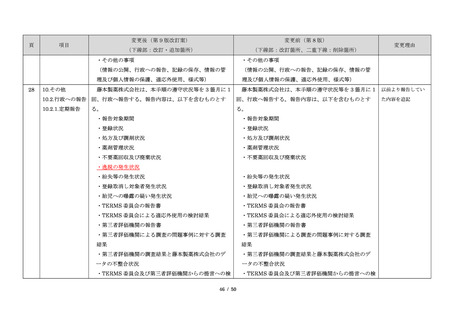
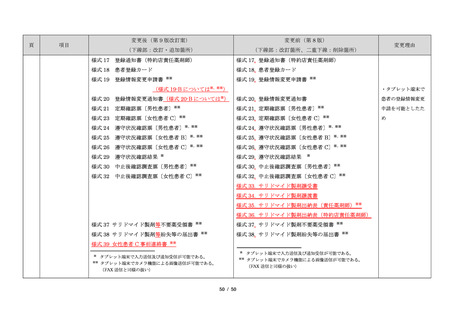
23
(前項続き)
変更後(第 9 版改訂案)
変更前(第 8 版)
(下線部:改訂・追加箇所)
(下線部:改訂箇所、二重下線:削除箇所)
変更理由
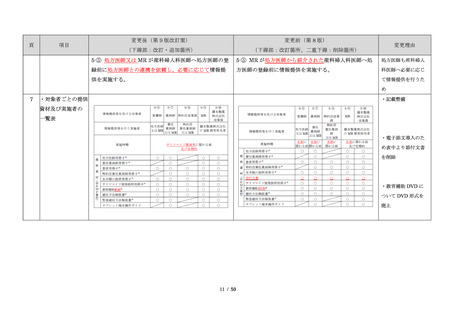
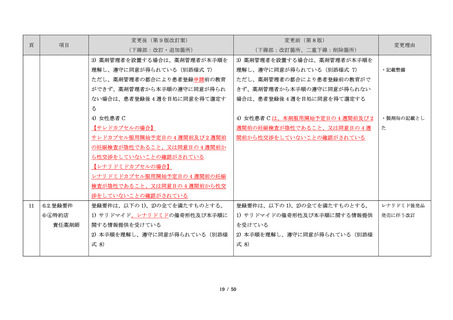
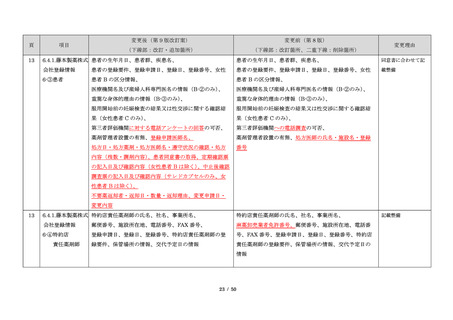
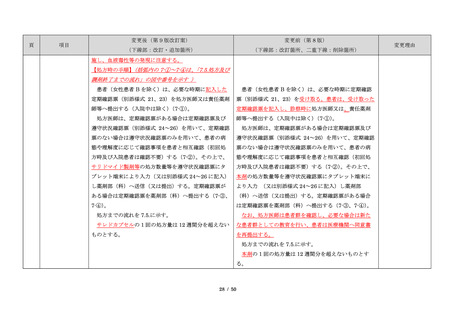
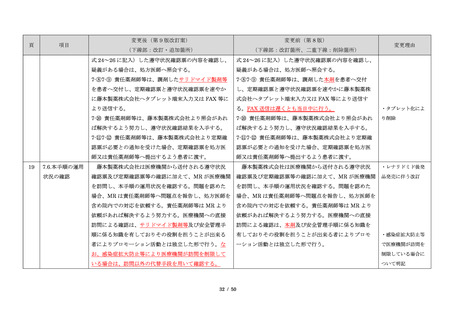
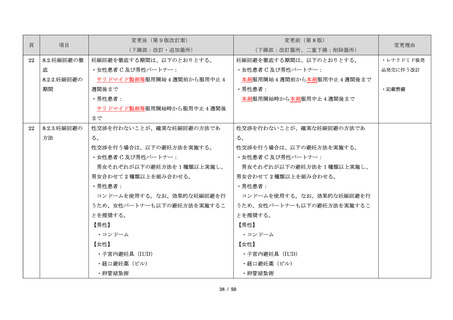
・製剤毎に記載した
妊娠検査実施時期
妊娠検査実施時期
【サレドカプセルの場合】
・本剤服用開始 4 週間前
・服用開始 4 週間前注)
・本剤服用開始 2 週間前
・服用開始 2 週間前
・本剤初回処方前 24 時間以内
・医療現場と患者さ
・4 週間を超えない間隔
んの利便性を考慮
・本剤服用中止時
し、初回処方前の妊
・本剤服用中止 4 週間後
娠検査の規定を変更
(記載なし)
血液毒性等に注意す
注)
・初回処方前(処方開始 3 日前から処方日までのいず
れかの日)
・4 週間を超えない間隔
同意日の 4 週間前から性交渉をして
いないことが確認された場合は不要
・記載整備
・服用中止時
・服用中止 4 週間後
【レナリドミドカプセルの場合】
・服用開始 4 週間前注)
・初回処方前(処方開始 3 日前から処方日までのいず
れかの日)
・4 週間を超えない間隔
・服用中止時
・服用中止 4 週間後
同意日の 4 週間前から性交渉をしていないことが確認
注)
された場合は不要
24
8.3.2.血液検査等
すべての患者に対し、定期的に血液検査等を実施し、
血液毒性等の発現に注意する。
ることを明記
41 / 50
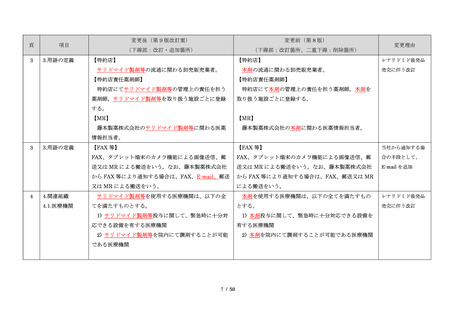
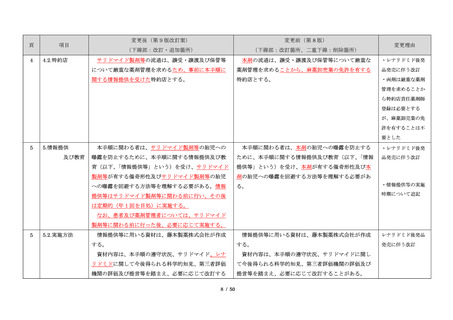
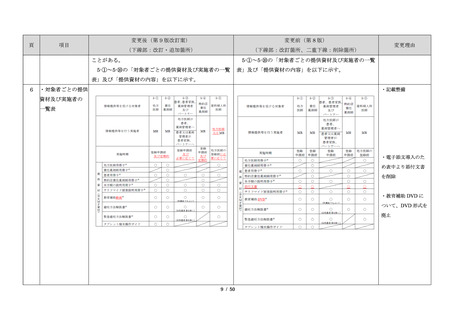
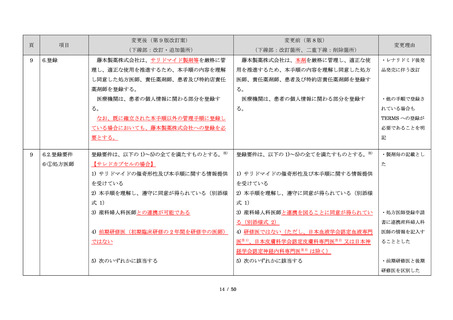
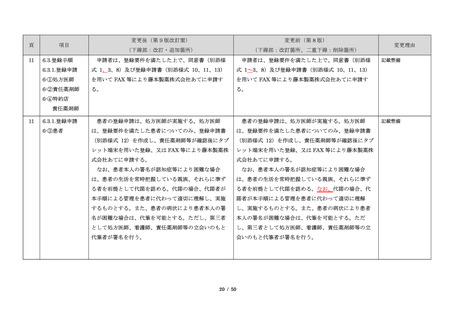
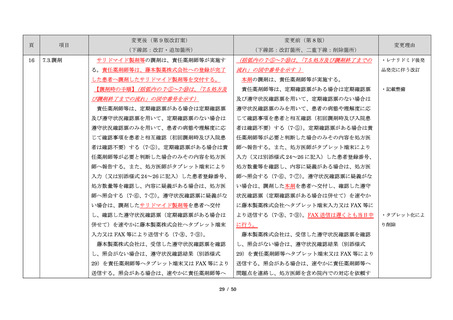
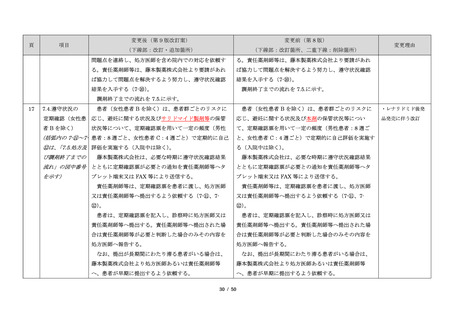
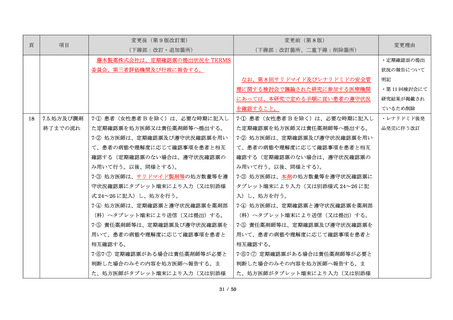
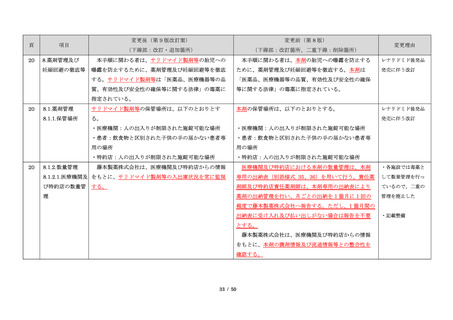
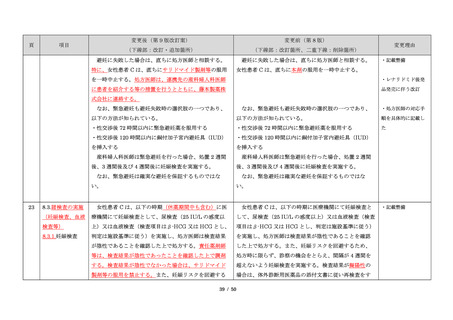
項目
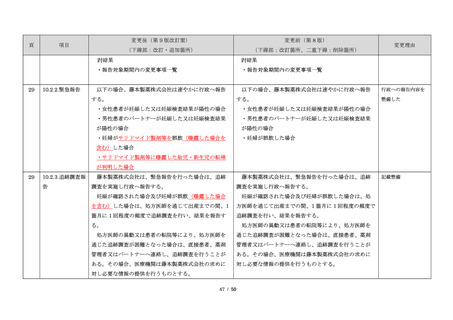
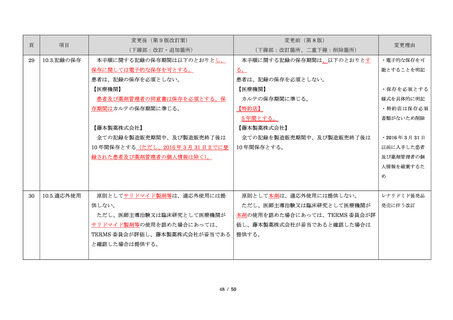
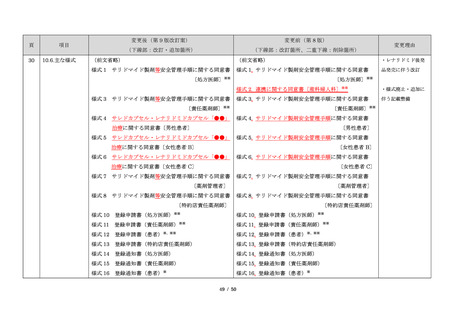
23
(前項続き)
変更後(第 9 版改訂案)
変更前(第 8 版)
(下線部:改訂・追加箇所)
(下線部:改訂箇所、二重下線:削除箇所)
変更理由
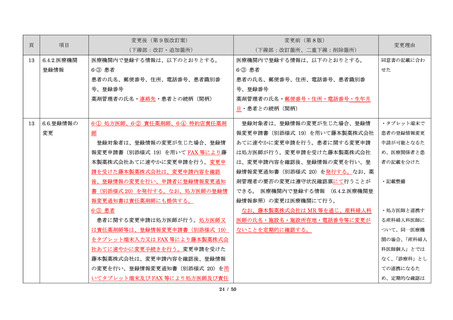
・製剤毎に記載した
妊娠検査実施時期
妊娠検査実施時期
【サレドカプセルの場合】
・本剤服用開始 4 週間前
・服用開始 4 週間前注)
・本剤服用開始 2 週間前
・服用開始 2 週間前
・本剤初回処方前 24 時間以内
・医療現場と患者さ
・4 週間を超えない間隔
んの利便性を考慮
・本剤服用中止時
し、初回処方前の妊
・本剤服用中止 4 週間後
娠検査の規定を変更
(記載なし)
血液毒性等に注意す
注)
・初回処方前(処方開始 3 日前から処方日までのいず
れかの日)
・4 週間を超えない間隔
同意日の 4 週間前から性交渉をして
いないことが確認された場合は不要
・記載整備
・服用中止時
・服用中止 4 週間後
【レナリドミドカプセルの場合】
・服用開始 4 週間前注)
・初回処方前(処方開始 3 日前から処方日までのいず
れかの日)
・4 週間を超えない間隔
・服用中止時
・服用中止 4 週間後
同意日の 4 週間前から性交渉をしていないことが確認
注)
された場合は不要
24
8.3.2.血液検査等
すべての患者に対し、定期的に血液検査等を実施し、
血液毒性等の発現に注意する。
ることを明記
41 / 50