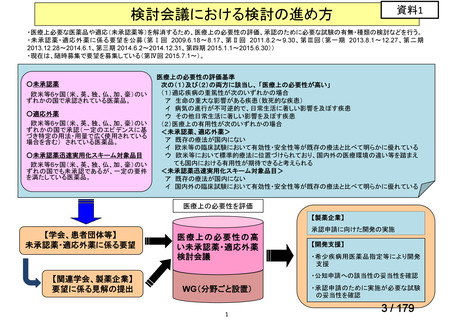
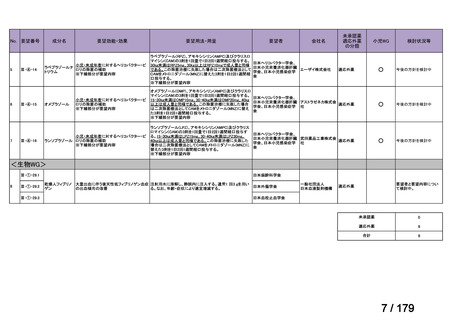
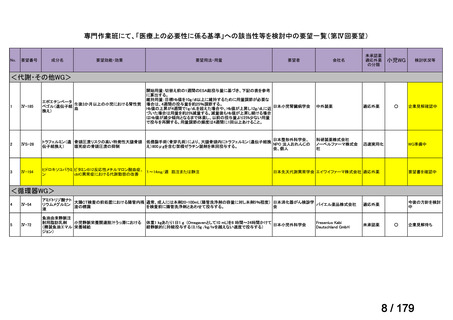
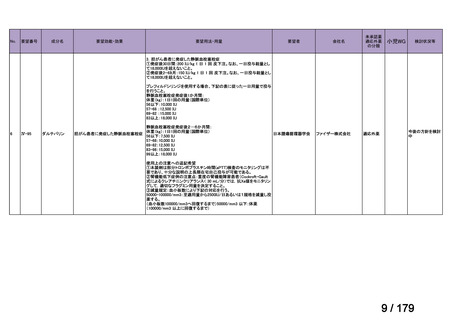
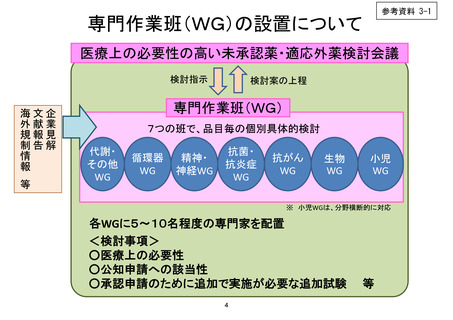
会議資料 (150 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00033.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第59回 7/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
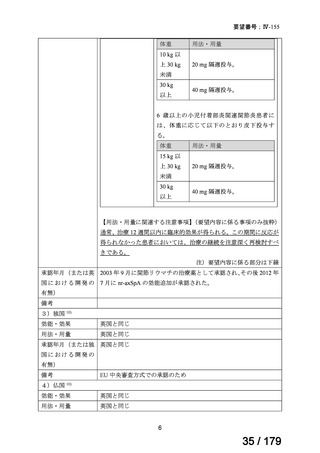
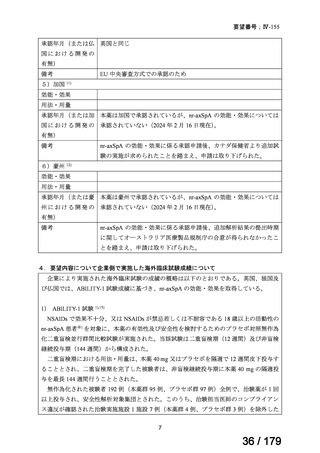
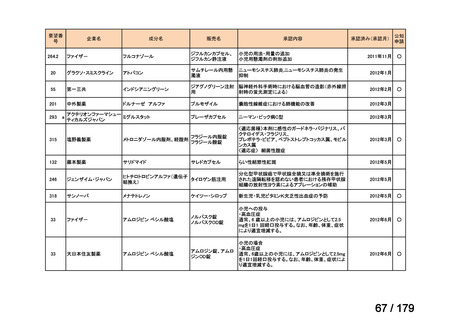
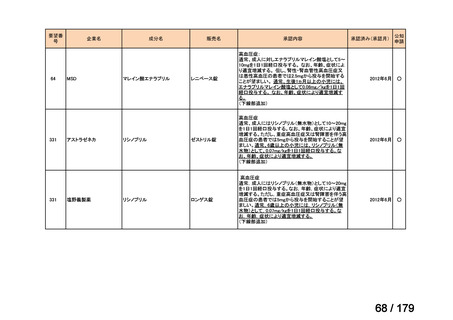
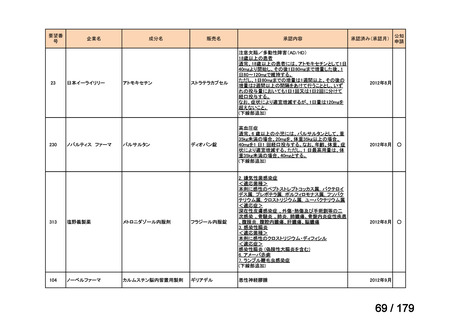
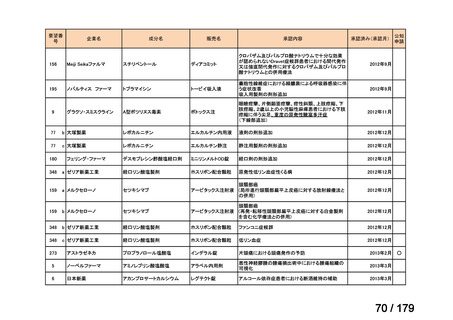
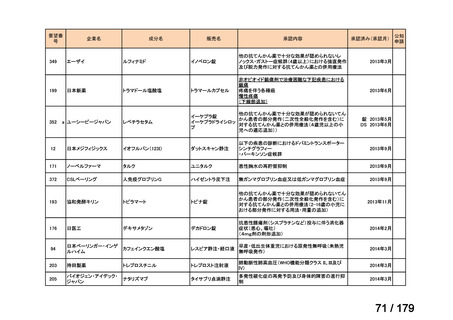
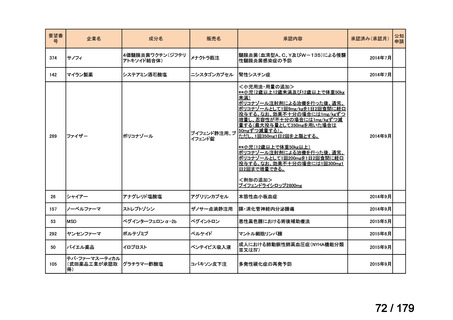
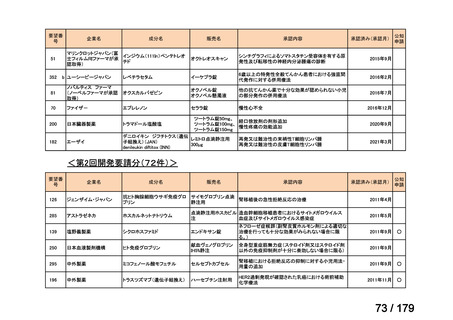
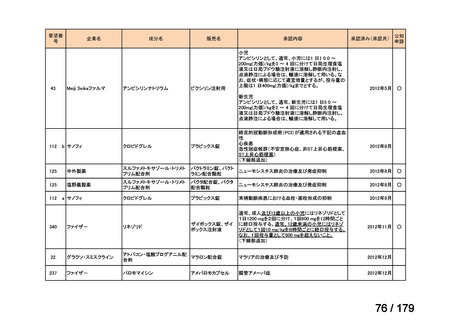
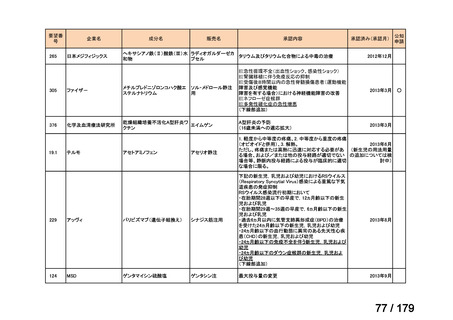
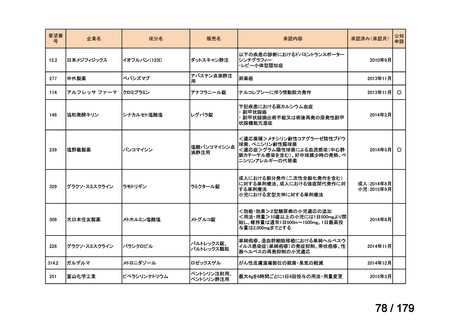
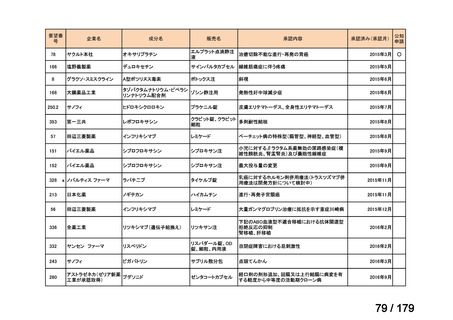
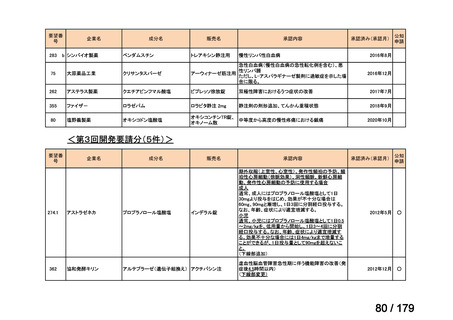
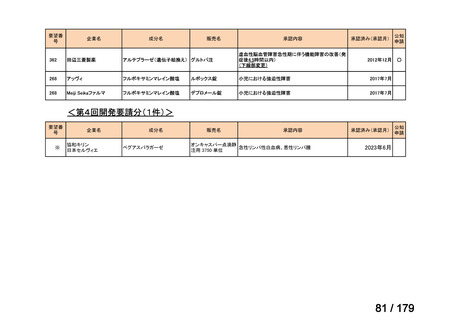
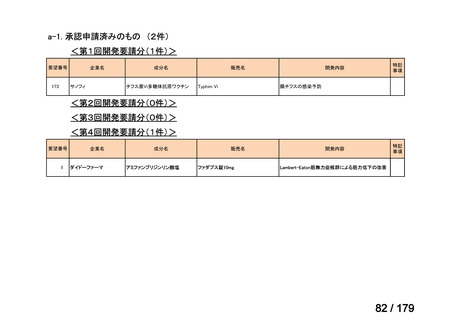
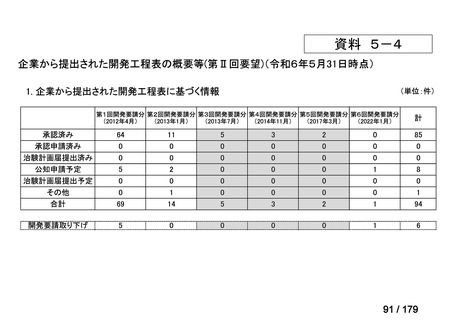
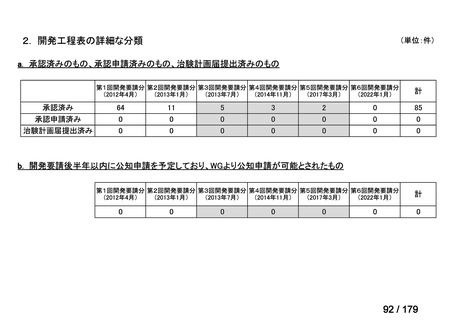
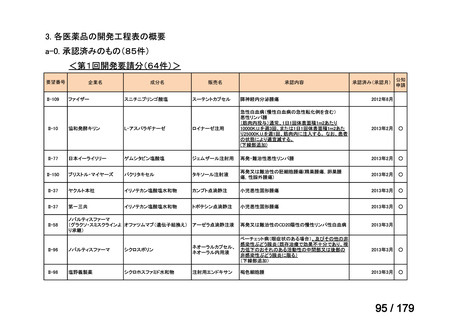
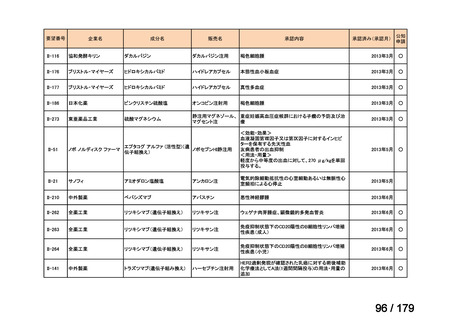
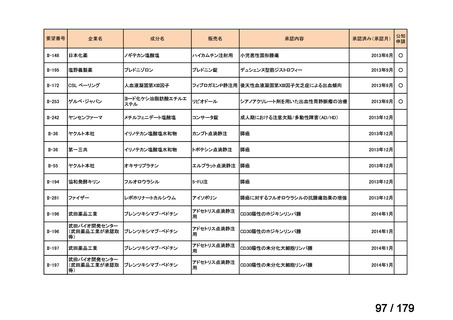
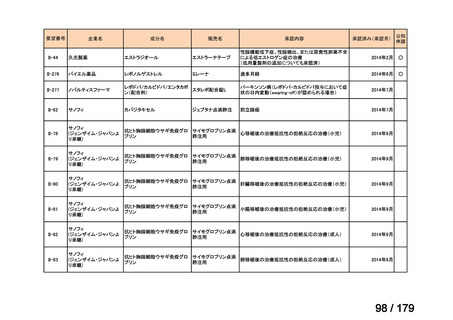
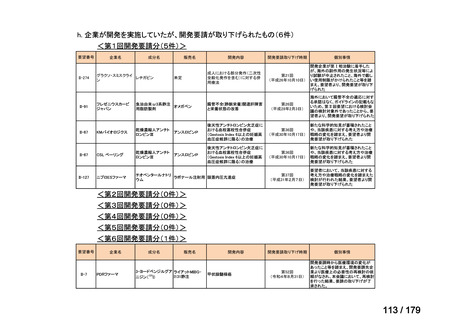
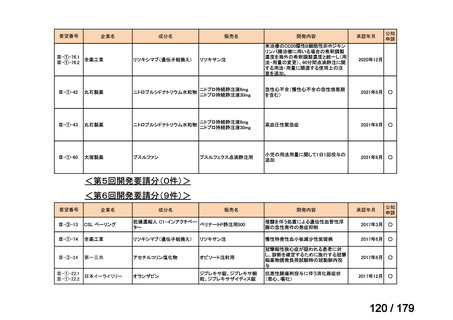
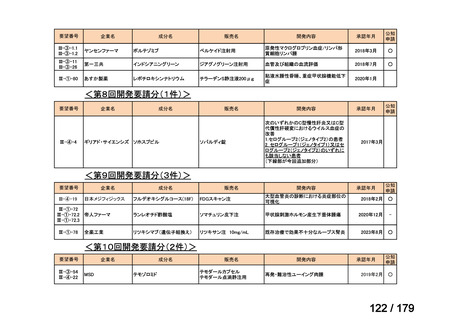
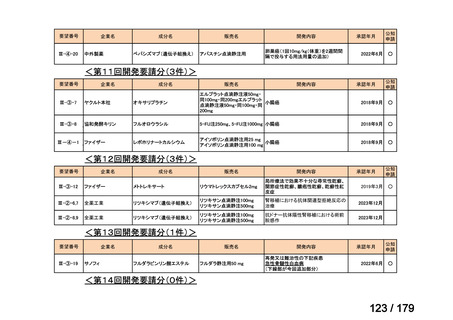
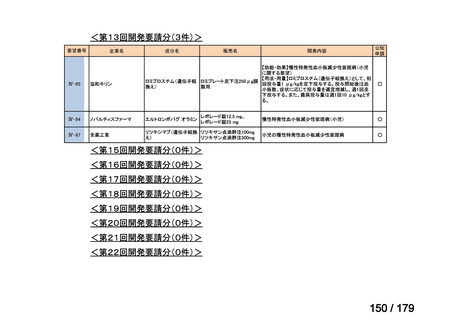
要望番号
企業名
成分名
販売名
公知
申請
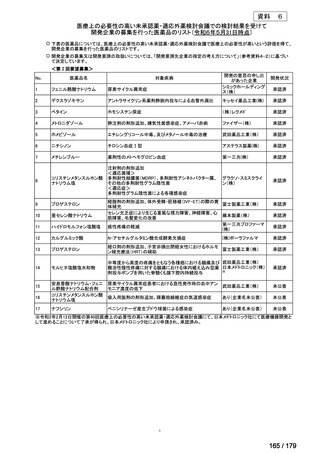
開発内容
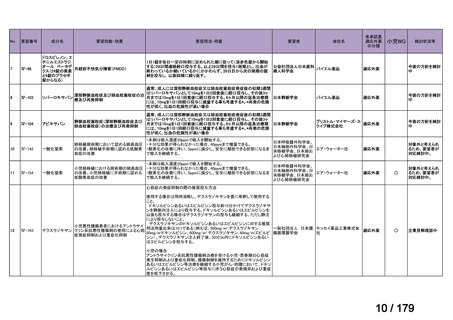
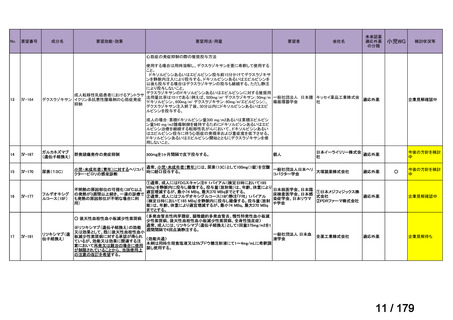
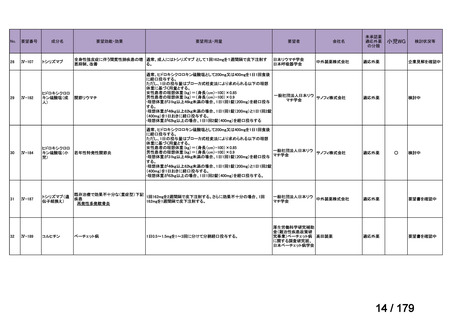
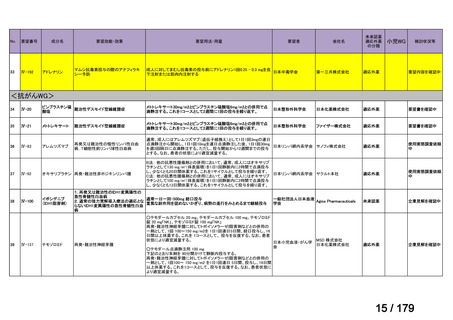
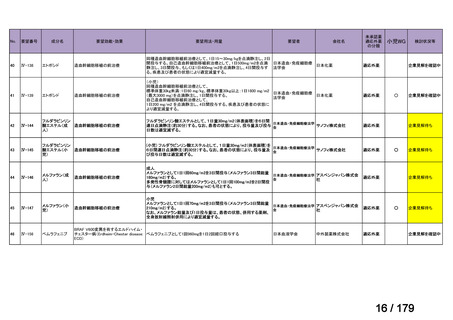
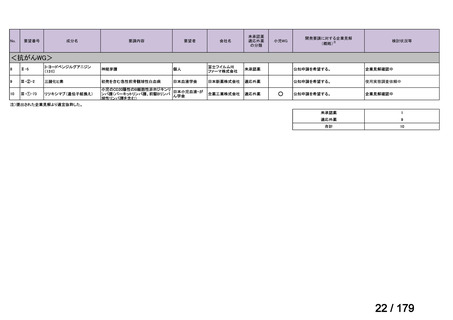
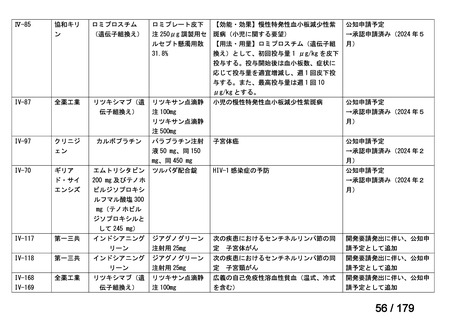
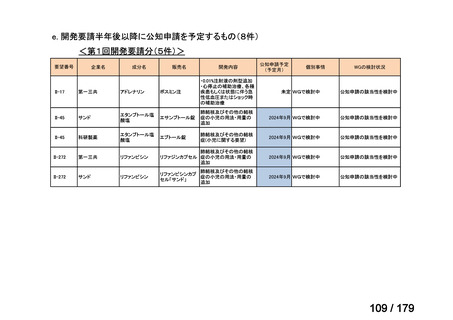
Ⅳ-85
協和キリン
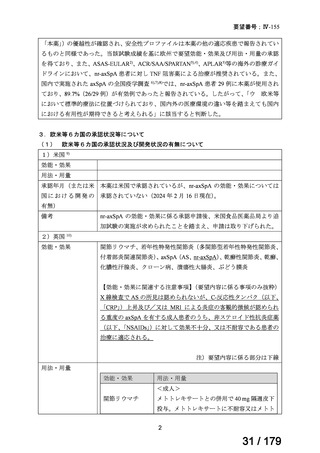
【効能・効果】慢性特発性血小板減少性紫斑病(小児
に関する要望)
【用法・用量】ロミプロスチム(遺伝子組換え)として、初
ロミプロスチム(遺伝子組 ロミプレート皮下注250μg調
回投与量1 μg/kgを皮下投与する。投与開始後は血
換え)
製用
小板数、症状に応じて投与量を適宜増減し、週1回皮
下投与する。また、最高投与量は週1回10 μg/kgとす
る。
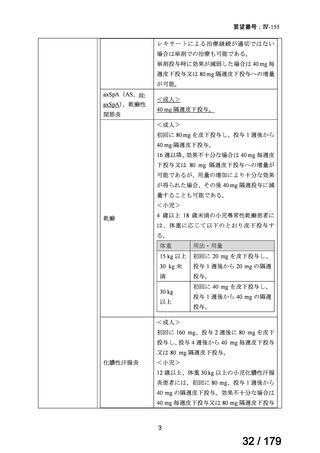
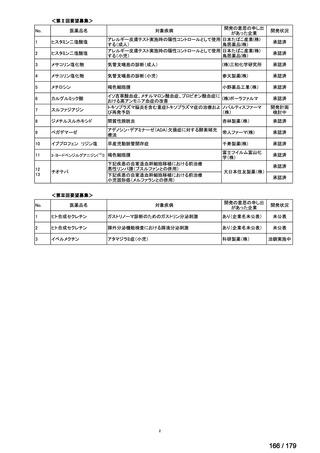
Ⅳ-84
ノバルティスファーマ
エルトロンボパグ オラミン
Ⅳ-87
全薬工業
リツキシマブ(遺伝子組換 リツキサン点滴静注100mg
え)
リツキサン点滴静注500mg
レボレード錠12.5 mg、
レボレード錠25 mg
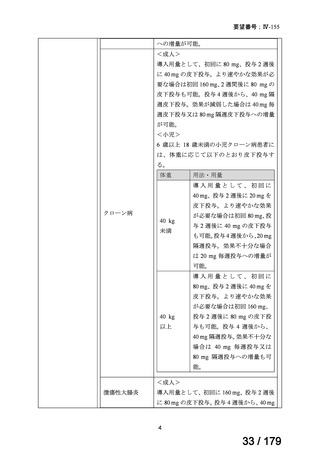
○
慢性特発性血小板減少性紫斑病(小児)
○
小児の慢性特発性血小板減少性紫斑病
○
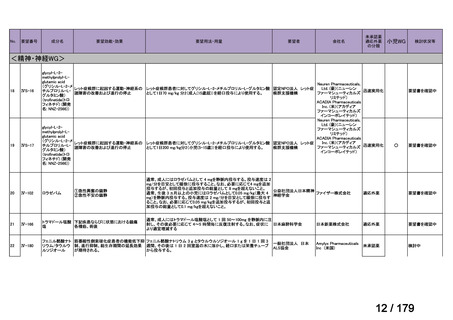
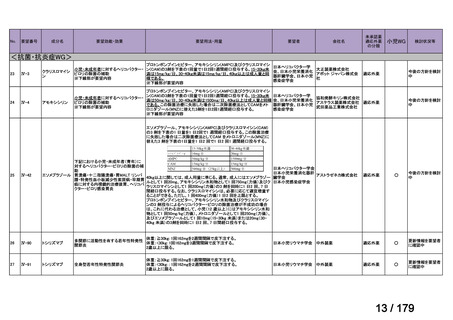
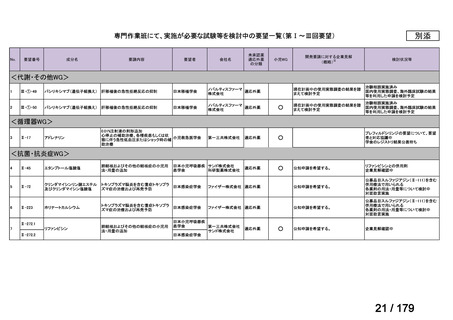
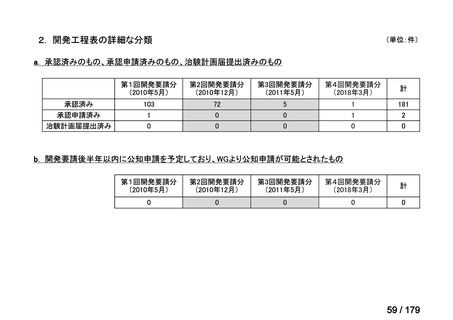
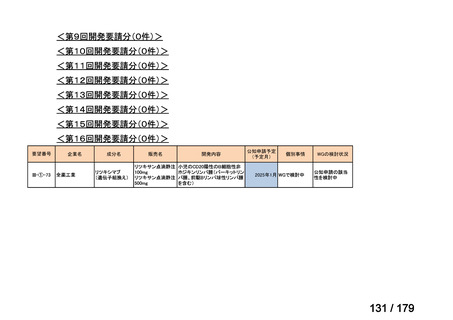
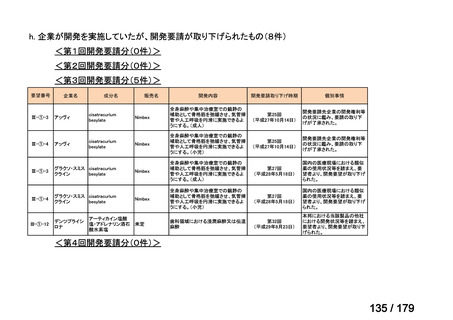
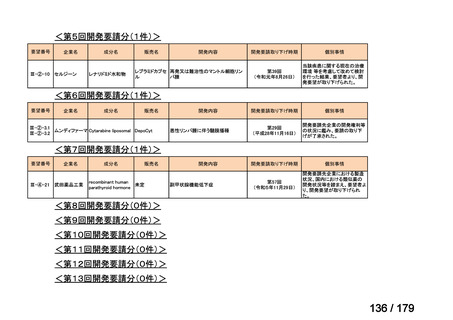
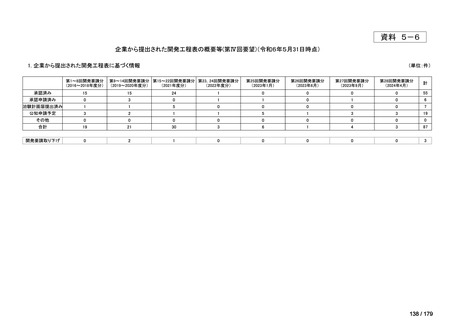
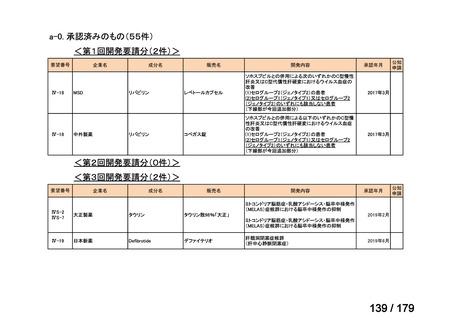
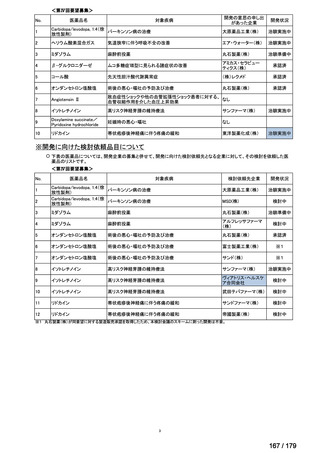
<第15回開発要請分(0件)>
<第16回開発要請分(0件)>
<第17回開発要請分(0件)>
<第18回開発要請分(0件)>
<第19回開発要請分(0件)>
<第20回開発要請分(0件)>
<第21回開発要請分(0件)>
<第22回開発要請分(0件)>
150 / 179