会議資料 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00033.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第59回 7/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
53
54
55
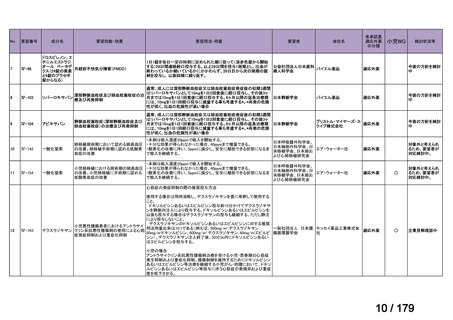
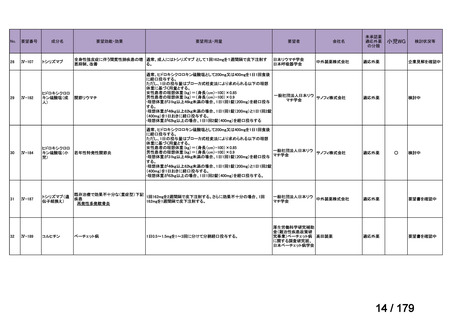
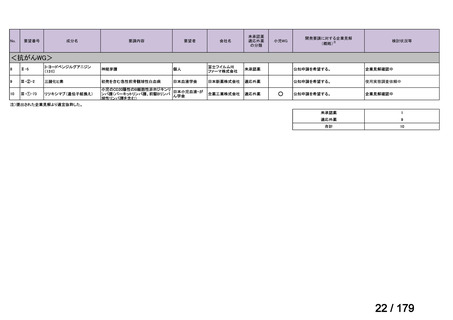
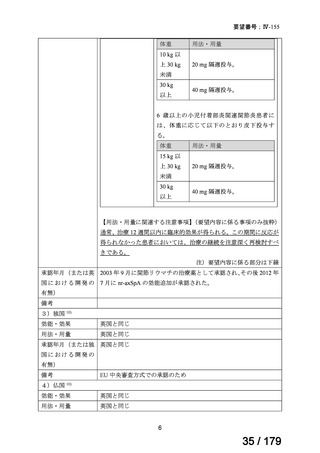
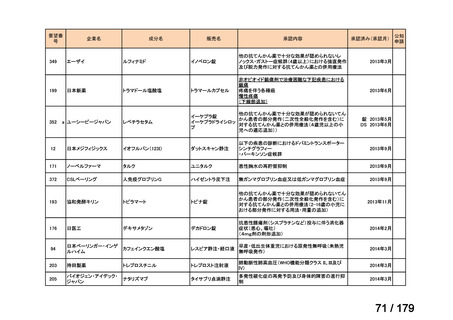
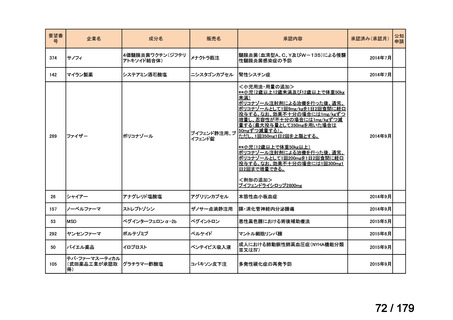
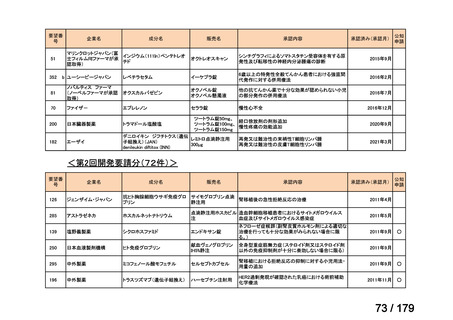
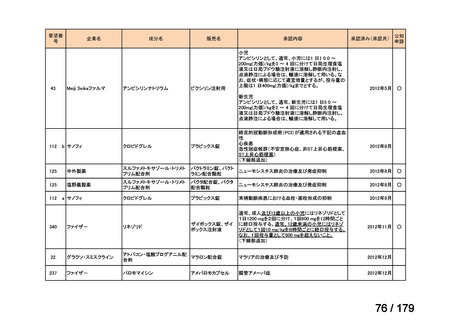
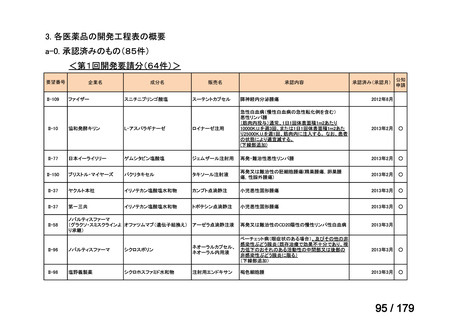
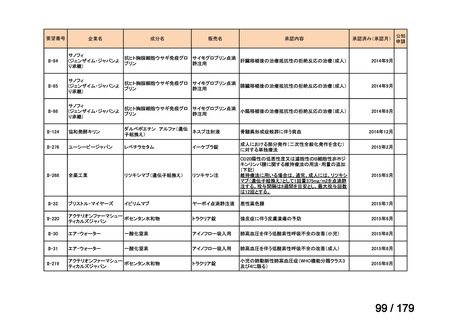
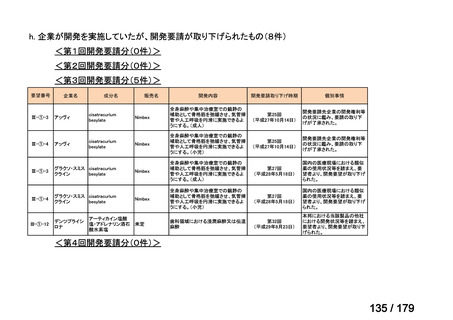
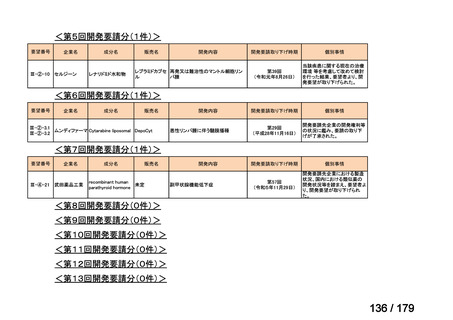
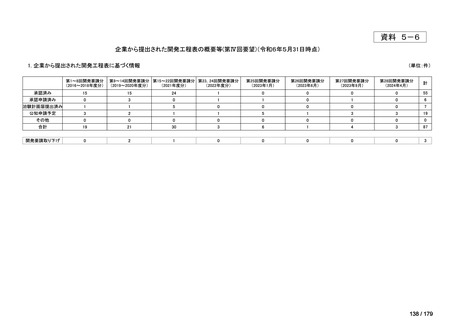
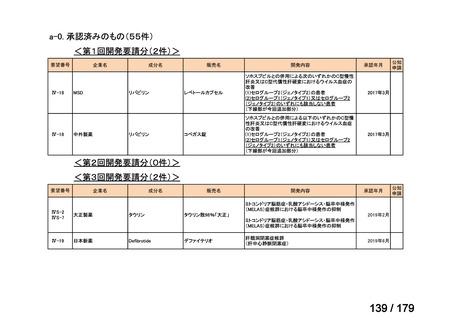
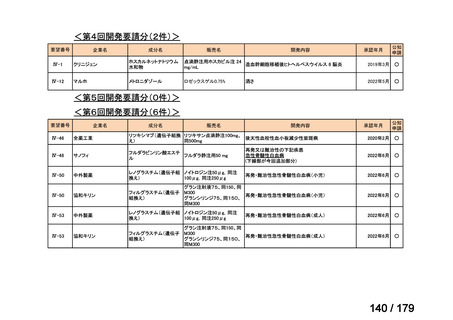
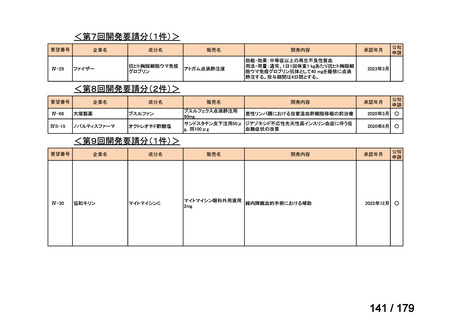
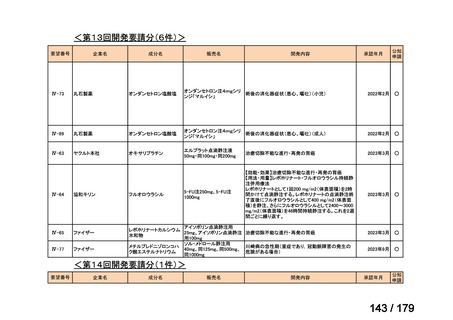
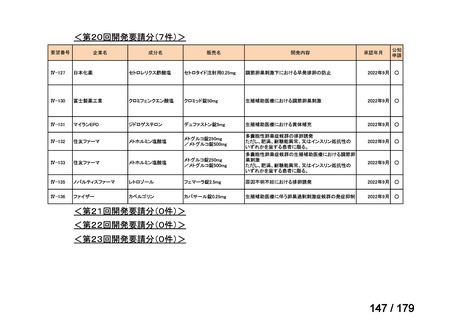
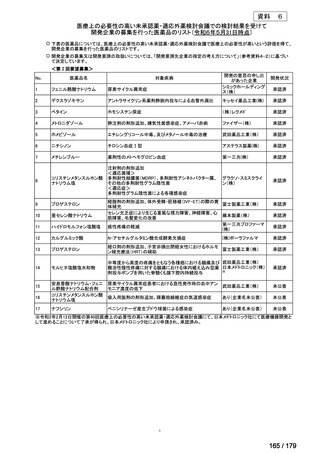
要望番号
成分名
要望効能・効果
要望用法・用量
要望者
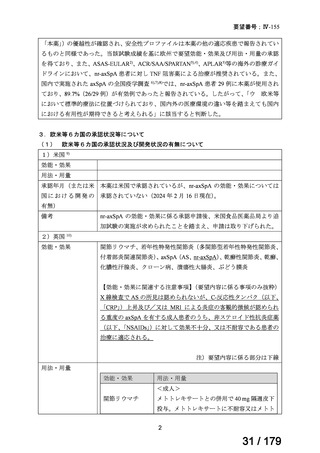
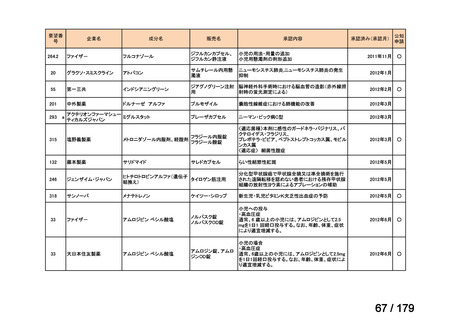
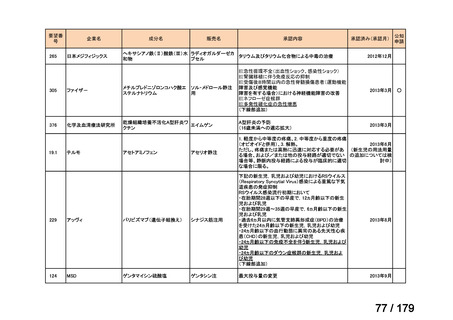
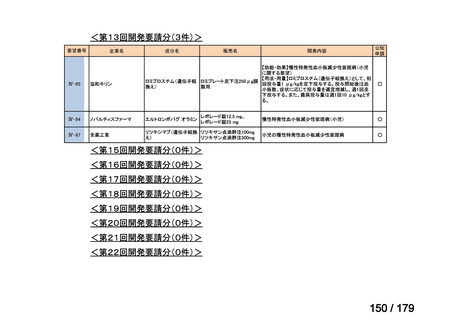
膵癌に対するレボホリナート・フルオロウラシル持続静注併用療法にお
いて、通常、成人にはレボホリナートとして1回200 mg/m2(体表面積)を2
時間かけて点滴静脈内注射する。レボホリナートの点滴静脈注射終了
直後にフルオロウラシルとして400 mg/m2(体表面積)を静脈内注射する 日本膵臓学会
とともに、フルオロウラシルとして2,400 mg/m2(体表面積)を46時間かけ
て持続静脈内注射する。これを2週間ごとに繰り返す。なお、病期、年
齢、患者の状態などにより適宜減量・削除する。
会社名
未承認薬
適応外薬
の分類
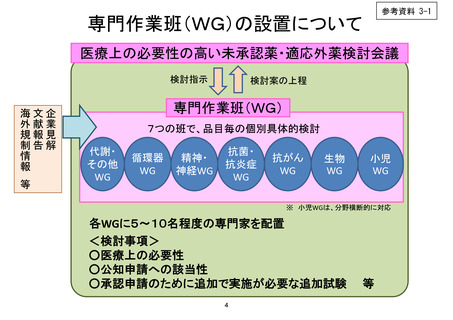
小児WG
検討状況等
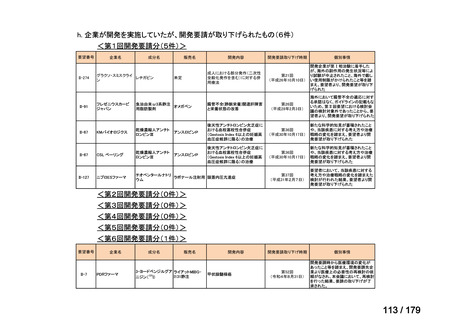
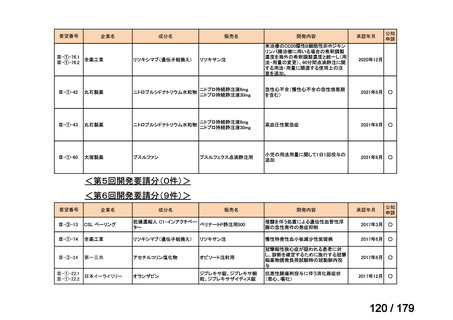
Ⅳ-174
レボホリナートカ 治癒切除不能な膵癌
ルシウム水和物 (取消線部削除)
適応外薬
企業見解を確認中
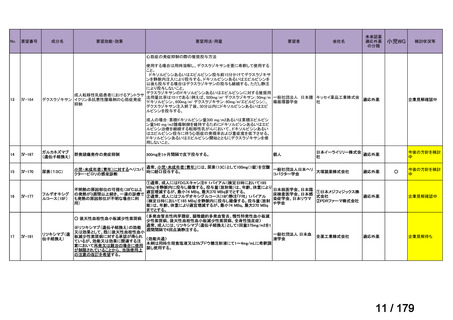
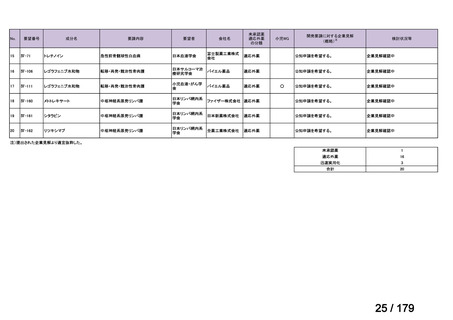
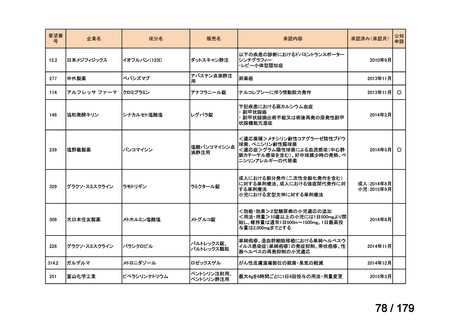
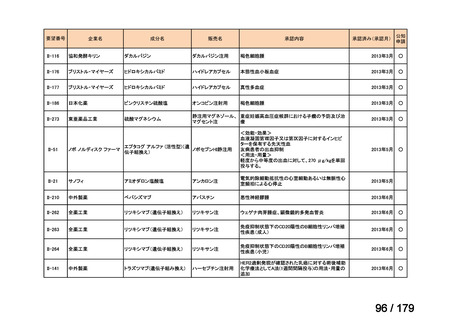
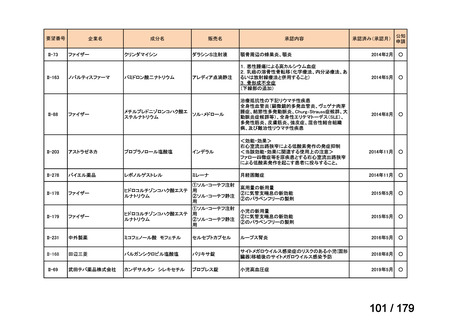
Ⅳ-179
日本臨床腫瘍学会、日
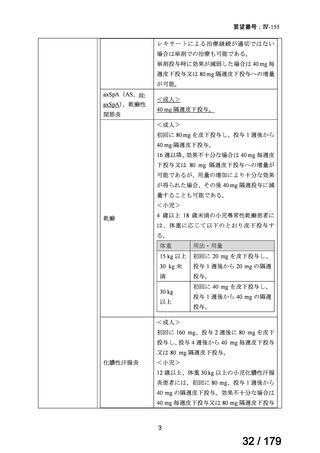
トラメチニブ ジメ
再発した低悪性度漿液性卵巣癌または腹膜癌に対しては、トラメチニブ
再発した低悪性度漿液性卵巣癌または
本婦人科腫瘍学会、卵 ノバルティスファーマ株式
チルスルホキシド
として2mgを1日1回、空腹時に経口投与する。なお、患者の状態により適
適応外薬
腹膜癌
巣がん体験者の会スマ 会社
付加物
宜減量する。
イリー
企業見解を確認中
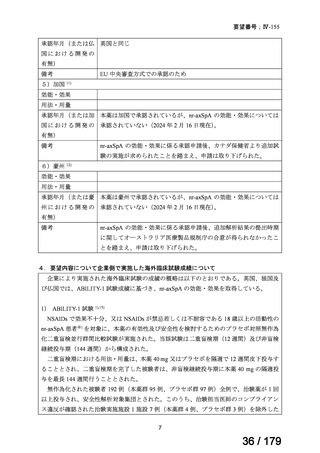
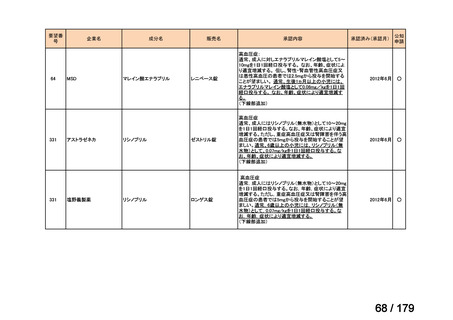
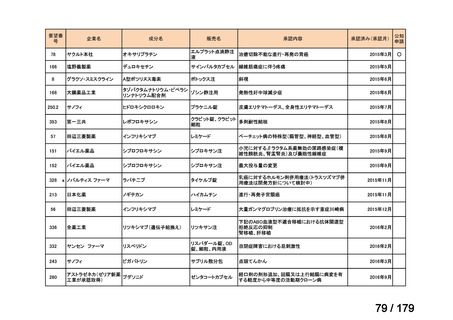
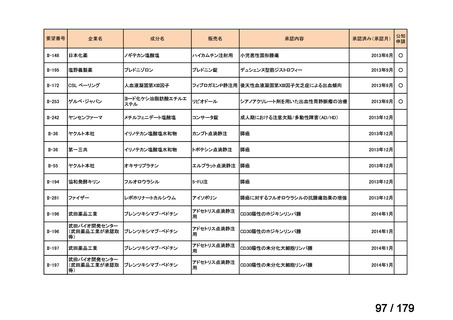
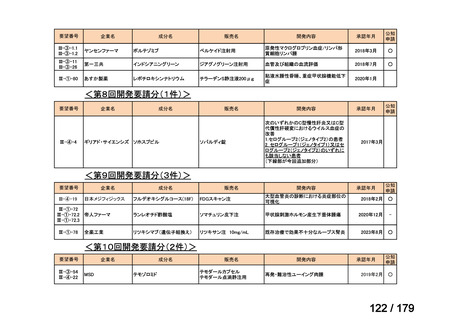
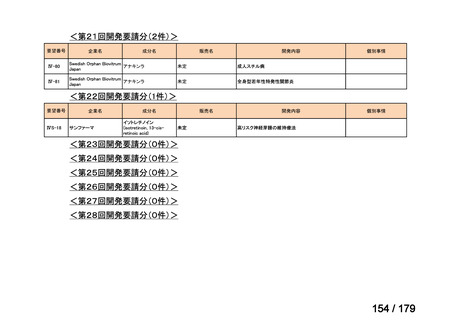
Ⅳ-183
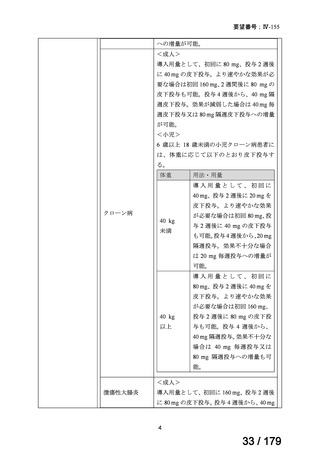
ナキシタマブ
再発/難治性高リスク神経芽腫
米国では各投与サイクルの1日目、3日目、5日目にDANYELZA(ナキシタ
マブ) 3mg/kg/日(最大150mg/日)を静脈内点滴で投与し、併用療法とし
2
てGM-CSFを-4日目から0日目に250μg/m /日、1日目から5日目に500
2
μg/m /日を皮下投与する。
神経芽腫の会
完全奏効または部分奏効するまで4週間ごとに繰り返す。その後は4週間
ごとに5サイクル追加する。その後8週間ごとに繰り返すことができるとし
て承認されている。
ファイザー株式会社
Y-mAbs Therapeutics,
Inc.社
未承認薬
○
要望書を確認中
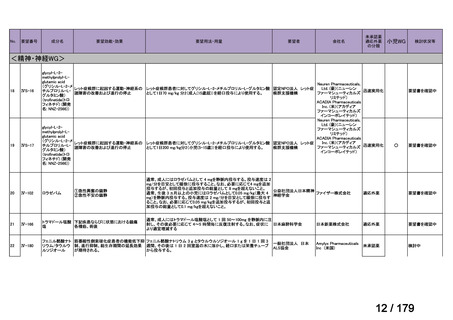
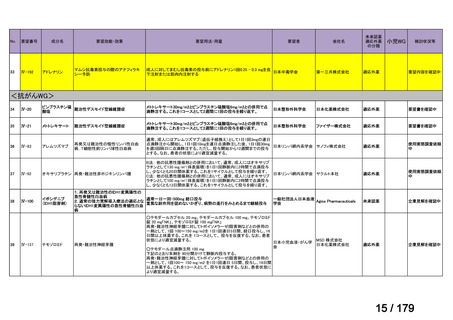
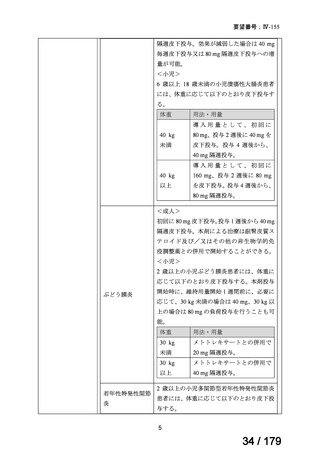
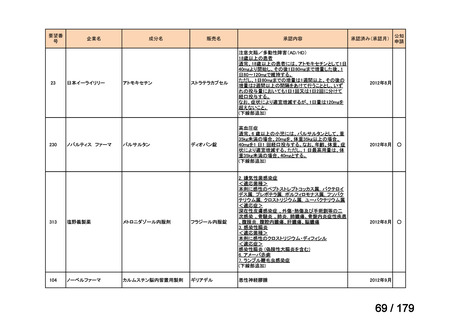
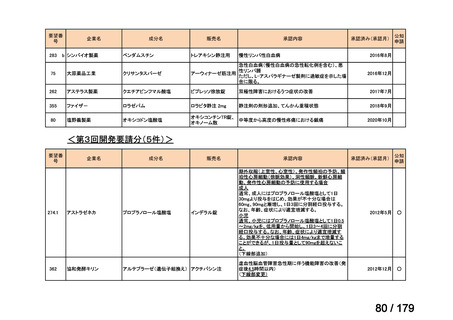
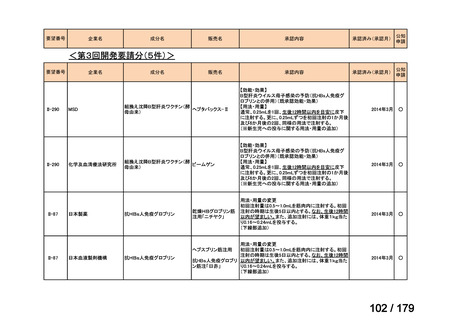
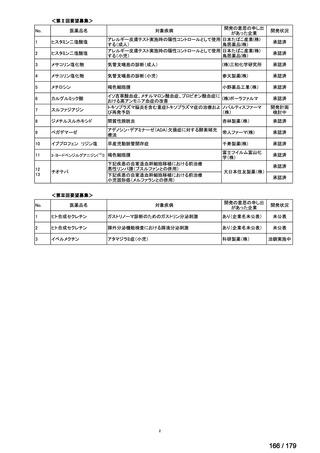
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3
週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
56
57
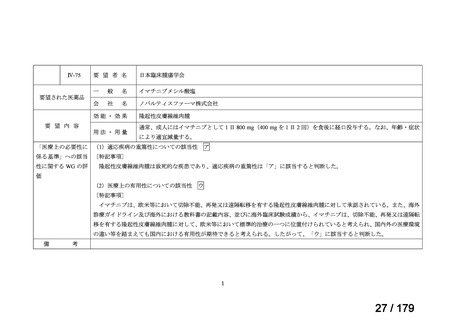
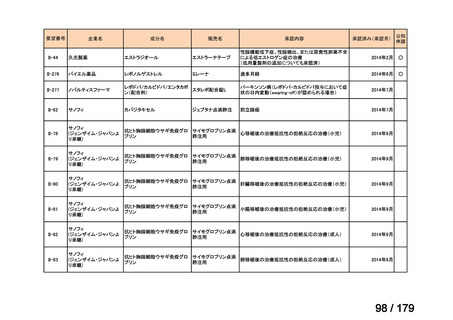
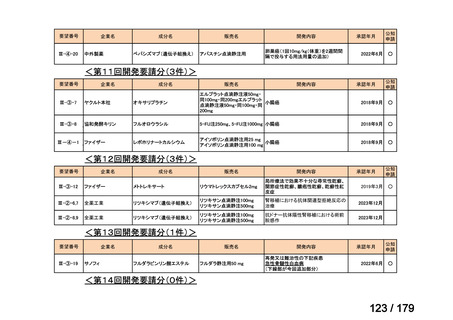
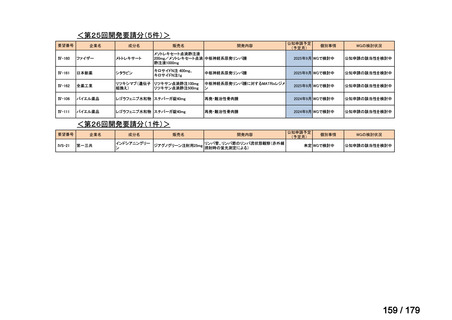
Ⅳ-190
ⅣS-30
がん化学療法後に増悪した絨毛性腫瘍
ペムブロリズマブ
(絨毛癌*、PSTT、ETT)
(遺伝子組換え)
*臨床的絨毛癌、high-risk GTNを含む
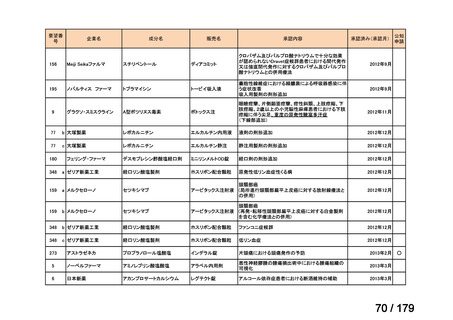
ニムスチン塩酸
塩
脳腫瘍
日本産科婦人科学会/
日本婦人科腫瘍学会/ MSD株式会社
日本絨毛性疾患研究会
適応外薬
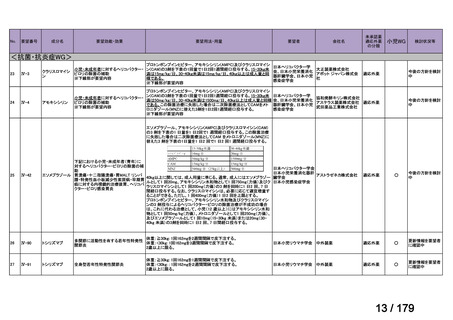
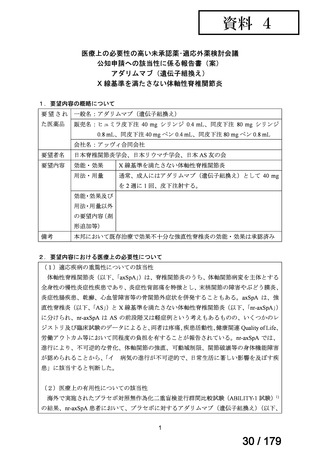
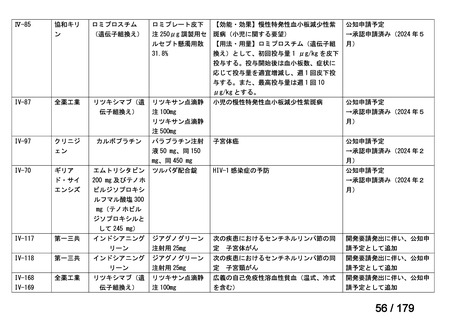
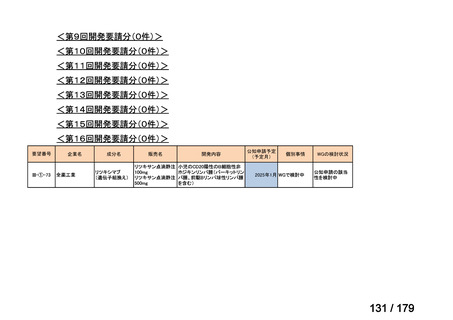
用法:convection-enhanced delivery(CED)を用いた腫瘍内局所投与(脳
内留置カテーテルからの低流量持続投与)
用量:ニムスチン塩酸塩0.75 mg/mLを数本のカテーテルからテント上病
変(大脳)は合計20mL投与、テント下病変(脳幹・小脳)は合計7mL投与 日本脳神経外科学会・ アルフレッサファーマ株式
迅速実用化
日本脳腫瘍学会
会社
企業見解を確認中
○
要望書を確認中
18 / 179