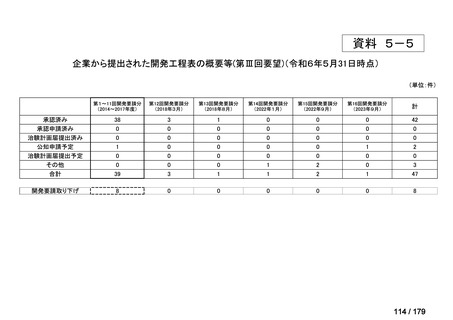
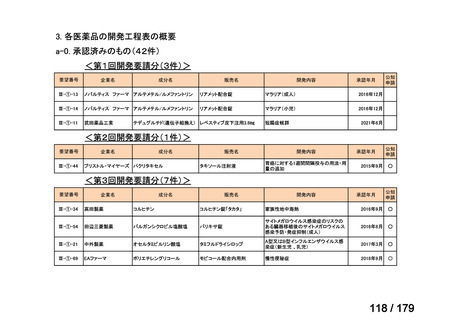
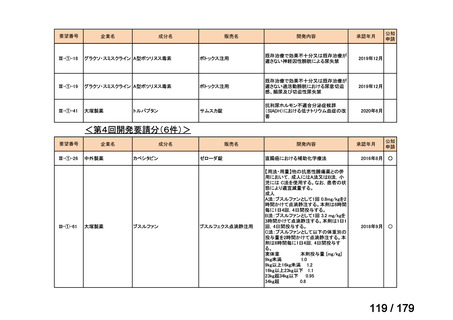
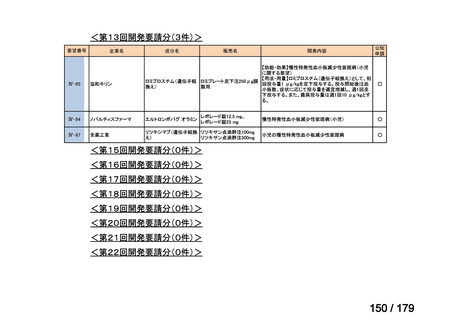
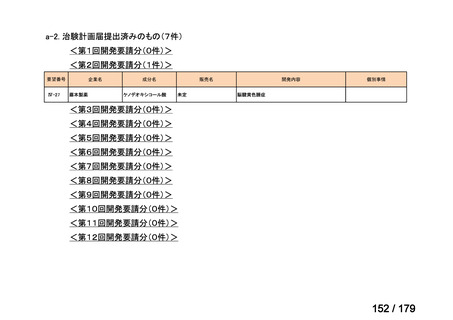
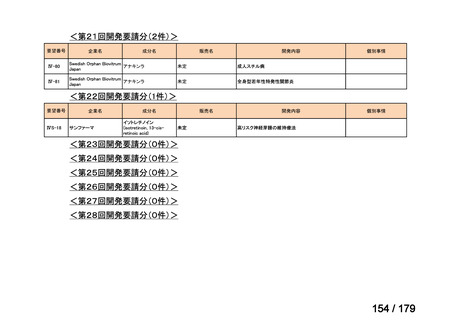
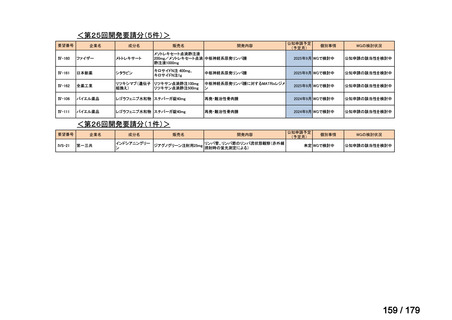
会議資料 (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00033.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第59回 7/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
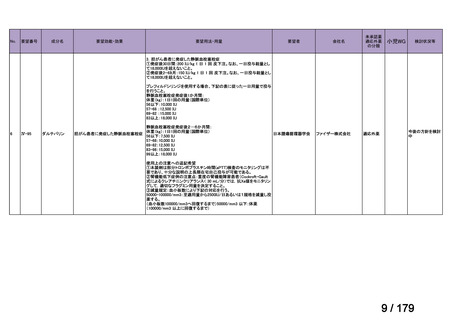
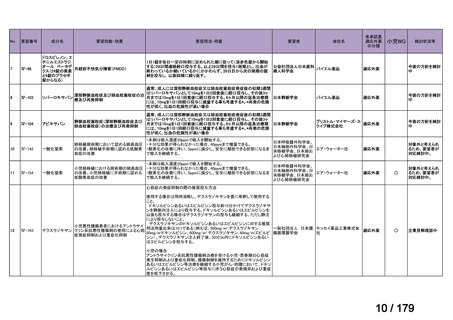
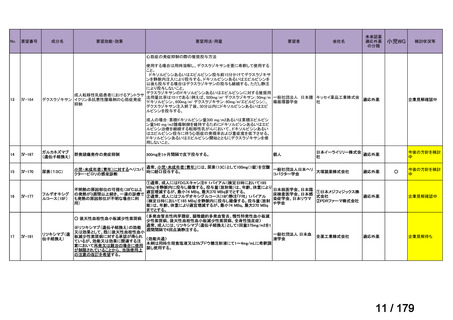
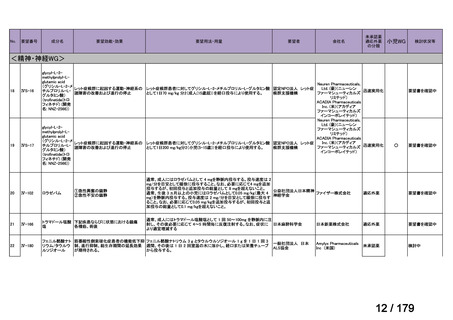
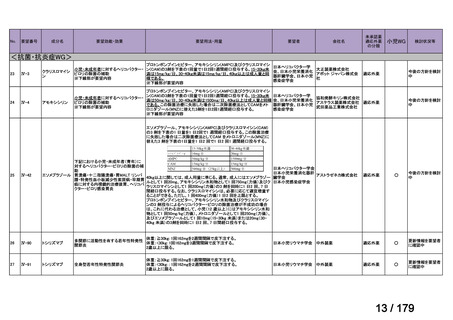
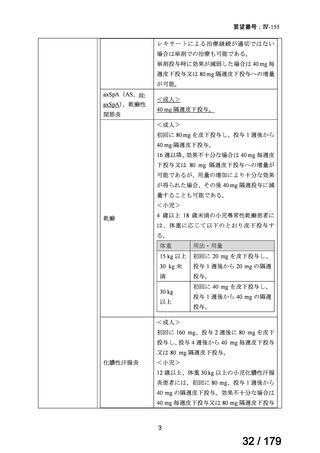
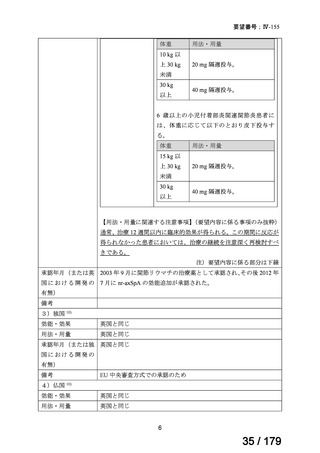
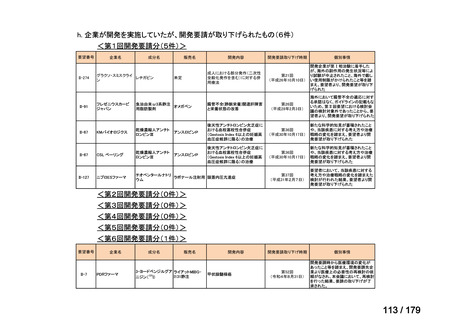
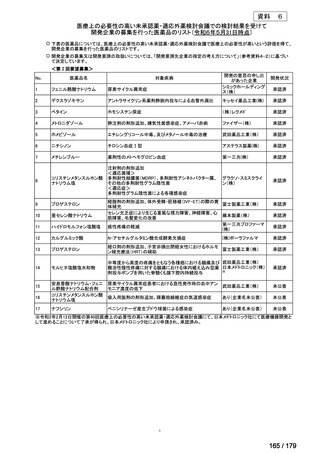
体重
用法・用量
10 kg 以
上 30 kg
20 mg 隔週投与。
未満
30 kg
以上
40 mg 隔週投与。
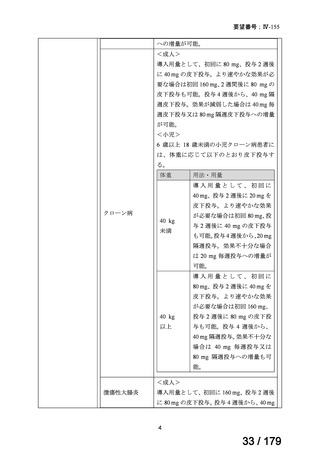
6 歳以上の小児付着部炎関連関節炎患者に
は、体重に応じて以下のとおり皮下投与す
る。
体重
用法・用量
15 kg 以
上 30 kg
20 mg 隔週投与。
未満
30 kg
以上
40 mg 隔週投与。
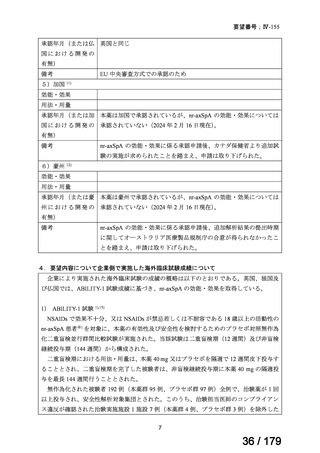
【用法・用量に関連する注意事項】
(要望内容に係る事項のみ抜粋)
通常、治療 12 週間以内に臨床的効果が得られる。この期間に反応が
得られなかった患者においては、治療の継続を注意深く再検討すべ
きである。
注)要望内容に係る部分は下線
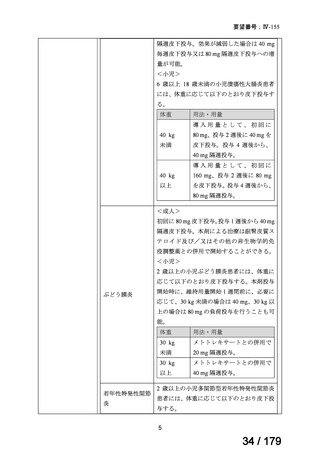
承認年月(または英 2003 年 9 月に関節リウマチの治療薬として承認され、その後 2012 年
国 に お け る 開 発 の 7 月に nr-axSpA の効能追加が承認された。
有無)
備考
3)独国 10)
効能・効果
英国と同じ
用法・用量
英国と同じ
承認年月(または独 英国と同じ
国における開発の
有無)
備考
EU 中央審査方式での承認のため
4)仏国 10)
効能・効果
英国と同じ
用法・用量
英国と同じ
6
35 / 179