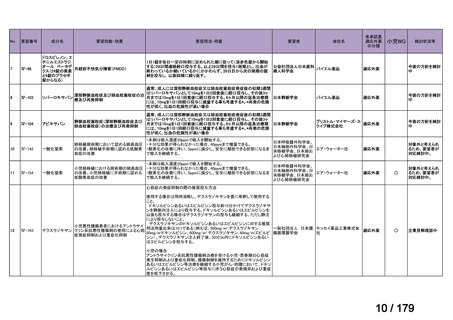
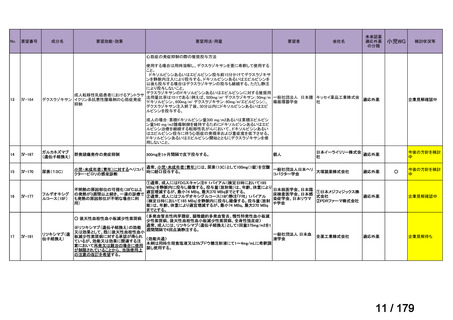
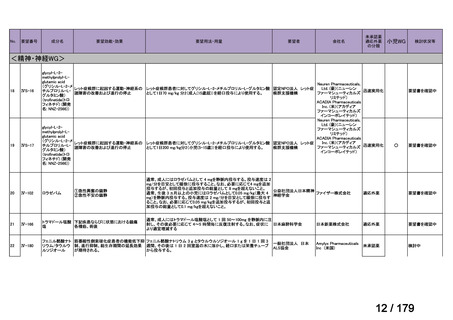
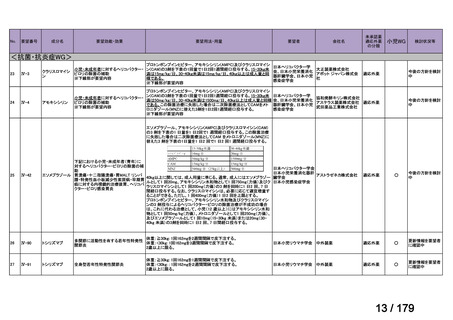
会議資料 (46 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00033.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第59回 7/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
していた。また、ABILITY-1 試験の非盲検継続投与期において 3 年間の安全性情報が収集
され、安全性上の懸念は認められなかった。加えて、
「5.要望内容に係る国内外の公表文
献・成書等について(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況」
の項に記載のとおり、本薬の 77 の臨床試験から収集した安全性情報を解析した結果、nraxSpA において新たな安全性上の懸念は認められていない。
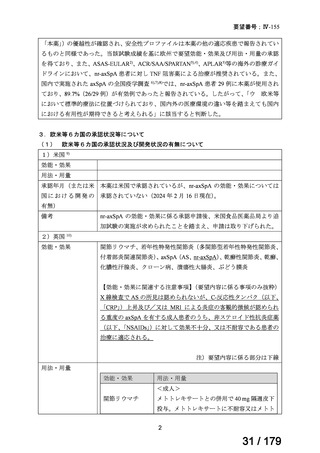
国内では、本薬は関節リウマチを含む複数の適応で承認されており、日本人に対する安
全性情報は集積されている。また、AS に係る効能・効果の承認後に実施され、既に完了し
ている AS 患者対象の特定使用成績調査(全例調査)において、実臨床下での日本人 AS 患
者への本薬投与に当たり新たな安全性上の懸念は認められていない。nr-axSpA は AS と同
一の疾患スペクトラムであると考えられていること及び海外の nr-axSpA 患者に対する本薬
の安全性情報を踏まえると、日本人 nr-axSpA 患者における本薬の安全性は、AS 及びその
他の適応疾患で報告されているものと同様であると考えられる。
以上より、検討会議は以下のように考える。
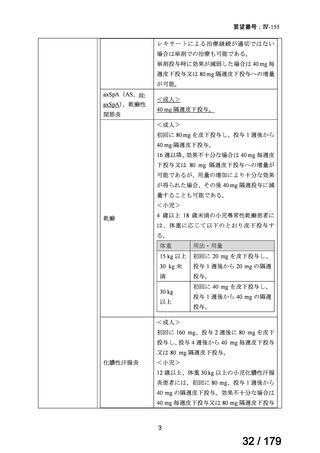
日本人 nr-axSpA 患者に対する本薬投与時の安全性を検討した臨床試験等の報告はないも
のの、海外臨床試験等において nr-axSpA 患者特有の有害事象は認められておらず、また、
要望用法・用量は本邦で承認されている AS の基本用法・用量と同じであることも踏まえ
ると、日本人 nr-axSpA 患者における本薬投与時の安全性は、添付文書での注意喚起を含め
た安全対策を AS と同様に行うことで管理可能と考える。
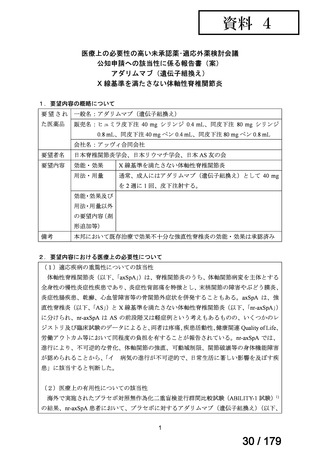
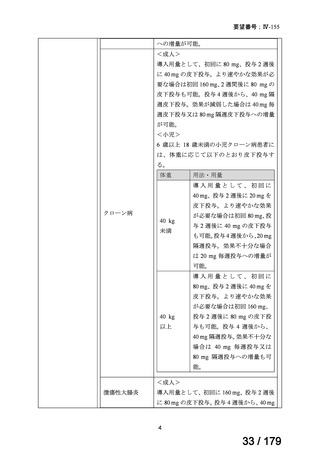
(3)要望内容に係る公知申請の妥当性について
検討会議は、海外の承認状況、国内外の診療ガイドラインにおける記載内容、公表文献、
国内における使用実態等に加え、それらを踏まえた上記(1)及び(2)の検討から、日本
人 nr-axSpA 患者における本薬 40 mg 隔週皮下投与の有効性及び安全性は、医学薬学上公知
であると判断可能と考える。
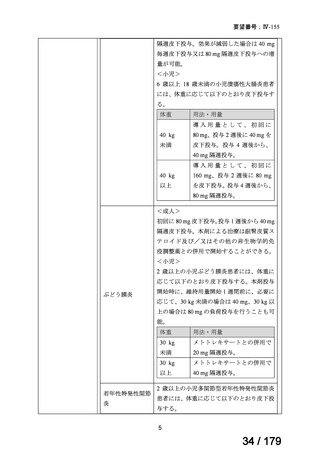
8.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
効能・効果については、効能・効果に関連する注意とともに、以下の設定とすることが
適当と検討会議は考える。その妥当性について以下に記す。
【効能・効果】(下線部追記)(今回の要望に関連する部分のみ抜粋)
既存治療で効果不十分な下記疾患
○X 線基準を満たさない体軸性脊椎関節炎
【効能・効果に関連する注意】(下線部追記)(今回の要望に関連する部分のみ抜粋)
<X 線基準を満たさない体軸性脊椎関節炎>
17
46 / 179