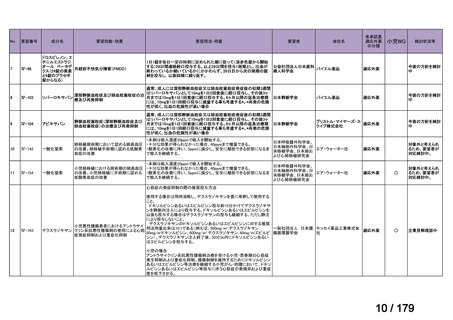
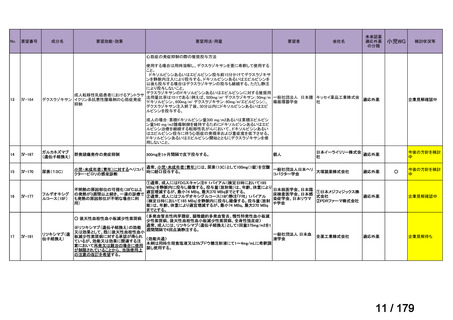
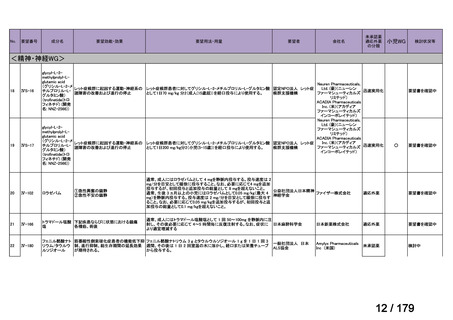
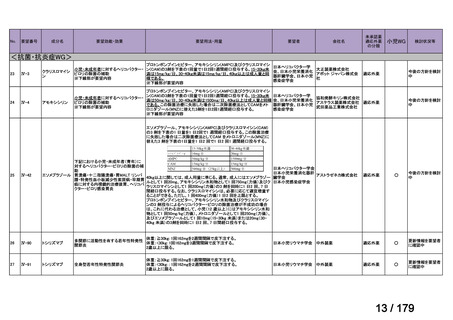
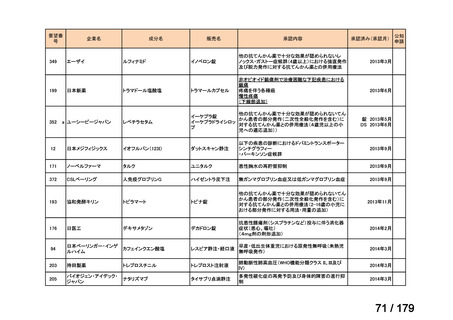
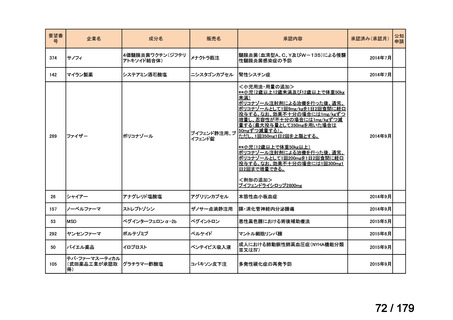
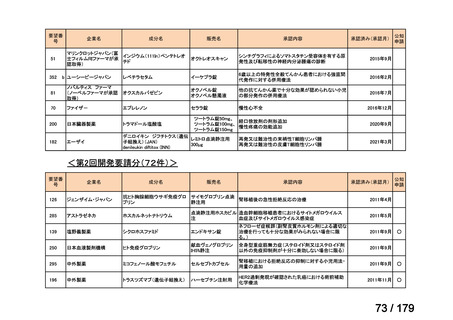
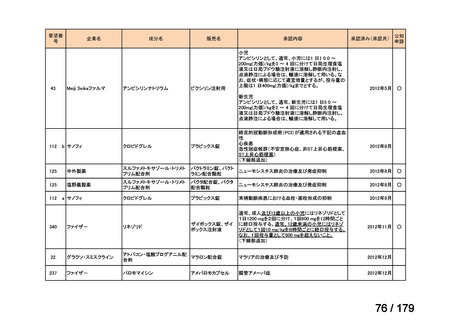
会議資料 (45 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00033.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第59回 7/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
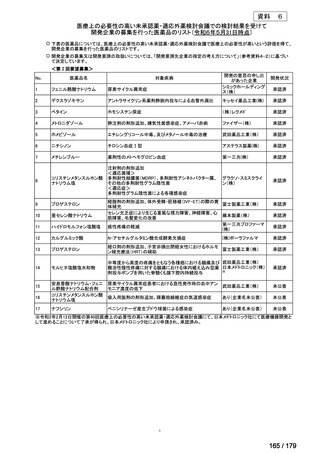
による治療を開始し、その後関節所見の改善を認めたものの、投与 4 回目(投与 6 週時点)
及び投与 5 回目(投与 8 週時点)の直前に増悪が確認され、投与 5 回目(投与 8 週時点)
よりメトトレキサートを漸増併用した。皮膚症状も増悪したため、投与 9 回目(投与開始
16 週時点)よりシクロスポリンの併用を開始した。その後、一時的に各症状は改善したが、
肝障害のためメトトレキサートを休薬し、同時に投与 14 回目(投与 28 週時点)より本薬
80 mg 隔週投与へ増量した。しかし症状増悪のため、投与 16 回目(投与 32 週時点)より本
薬 40 mg 毎週投与に変更し、症状の改善がみられた。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
海外では、ABILITY-1 試験において主要評価項目とされた ASAS40 反応率でプラセボに
対する本薬の優越性が示され(「4.要望内容について企業側で実施した海外臨床試験成績
について」の項参照)、欧州では、当該試験成績を踏まえて本薬が nr-axSpA に対して承認
されている。また、海外の診療ガイドラインでは、本薬を含めた TNF 阻害薬の臨床試験成
績に基づいて、nr-axSpA を含む NSAIDs で効果不十分な axSpA に対して、TNF 阻害薬の使
用が推奨されている。
国内において、本薬の nr-axSpA 患者を対象とした臨床試験の報告はないものの、「6.
本邦での開発状況(経緯)及び使用実態について(2)要望内容に係る本邦での臨床試験
成績及び臨床使用実態について」の項に示したとおり、全国疫学調査において、日本人 nraxSpA 患者に対する本薬の使用実態及び有効例が認められた旨の報告がなされている。ま
た、本薬は nr-axSpA と同一の疾患スペクトラムと考えられている AS に対して本邦で承認
されており、AS と nr-axSpA は X 線基準を満たす所見※5 の有無を除き、症状は共通してい
ることから、nr-axSpA の臨床症状に対する本薬の有効性は期待できると考えられる。
※5 1984年改訂ニューヨーク基準(Arthritis Rheum 1984; 27: 361-8)に基づき、単純X線画像所見で両側Grade 2
以上又は片側Grade 3以上の仙腸関節炎が認められる。
以上より、医療上の必要性の高い未承認薬・適応外薬検討会議(以下、
「検討会議」)は、
国内外の公表文献、診療ガイドライン等における記載状況、国内における使用実態の報告
から、日本人 nr-axSpA 患者に対する本薬投与による有効性は医学薬学上公知であると判断
した。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
海外で実施された ABILITY-1 試験における有害事象の発現状況は「4.要望内容につい
て企業側で実施した海外臨床試験成績について」の項に記載のとおりであり、nr-axSpA 患
者における安全性プロファイルは、AS 及びその他の適応疾患で報告されているものと一致
16
45 / 179