会議資料 (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00033.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第59回 7/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
検索結果:56 報
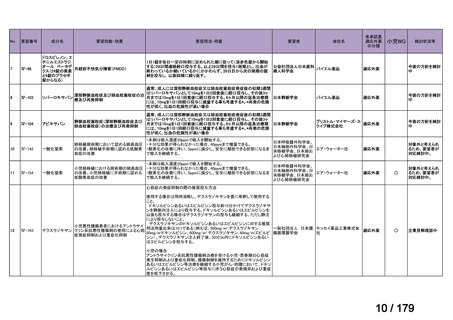
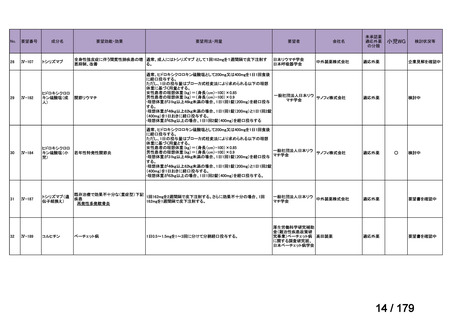
方法 2
データベース:医中誌
検索日:2024 年 2 月 8 日
検索式:adalimumab and (non-radiographic or nr-axSpA or X 線基準を満たさない)
検索結果:8 報
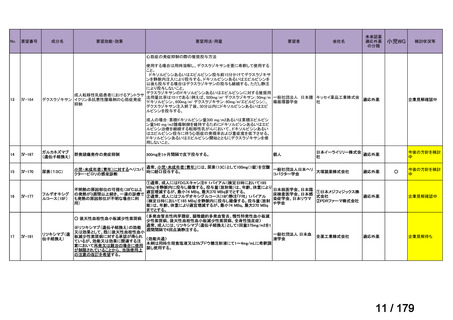
検索の結果、本邦で実施された nr-axSpA 患者を対象とした本薬の臨床試験の報告は認め
られなかったが、nr-axSpA 患者に対して本薬を使用した症例報告が 2 報 15),16)選定され、こ
の 2 報は同一症例に関する報告であった。当該症例報告の内容については、「6.本邦で
の開発状況(経緯)及び使用実態について(2)要望内容に係る本邦での臨床試験成績及
び臨床使用実態について」の項参照。
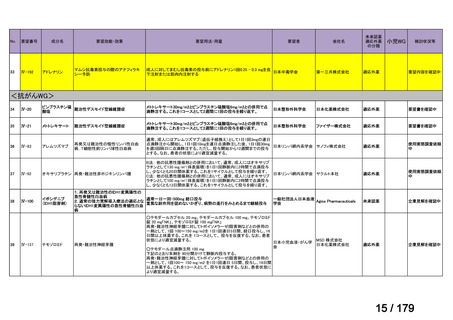
(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況
1) Burmester GR et al. Long-Term Safety of Adalimumab in 29,967 Adult Patients From Global
Clinical Trials Across Multiple Indications: An Updated Analysis. Adv Ther 2020; 37: 364-8017)
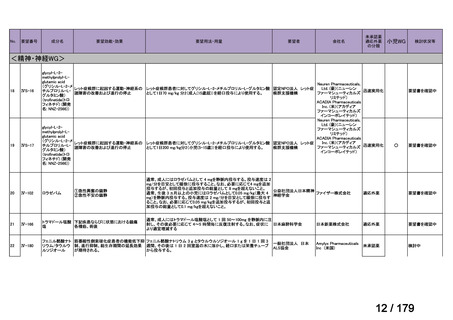
成人の尋常性乾癬、化膿性汗腺炎、関節リウマチ、AS、乾癬性関節炎、nr-axSpA、末梢
性脊椎関節炎、クローン病、潰瘍性大腸炎及び非感染性ぶどう膜炎患者を対象とした 77 の
臨床試験の安全性情報を収集し、本薬の長期安全性を評価した論文である。安全性の評価
には、本薬の初回投与後から最終投与後 70 日(本薬の消失半減期の 5 倍)以内に発現した
有害事象及び重篤な有害事象を含めた。総計で 29,967 人の患者(曝露:56,916 人・年)が
対象とされ、そのうち nr-axSpA 患者は 863 人(曝露:709 人・年)であった。最も高頻度
に報告された注目すべき重篤な有害事象は感染症であり、その発現頻度は、全体集団で 3.7
件/100 人・年、nr-axSpA 患者で 2.5 件/100 人・年であった。nr-axSpA 患者に認められた主
な重篤な感染症は蜂巣炎(0.6 件/100 人・年)及び虫垂炎(0.3 件/100 人・年)であった。
また、nr-axSpA 患者では、その他の注目すべき重篤な有害事象として、活動性結核、日和
見感染(口腔カンジダ症及び結核を除く)
、ループス様症候群、並びに悪性腫瘍(リンパ腫、
肝脾 T 細胞リンパ腫、白血病、非黒色腫皮膚癌及び黒色腫を除く)が認められ、その発現
頻度はいずれも 0.1 件/100 人・年であった。なお、全体集団におけるこれらの事象の発現頻
度はそれぞれ 0.2、<0.1、<0.1 及び 0.6 件/100 人・年であった。
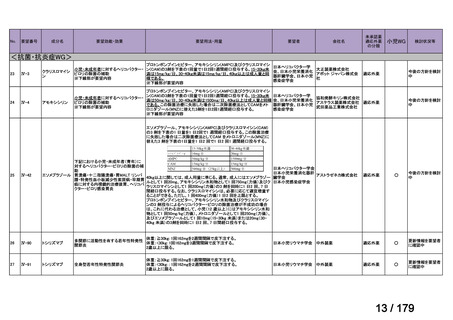
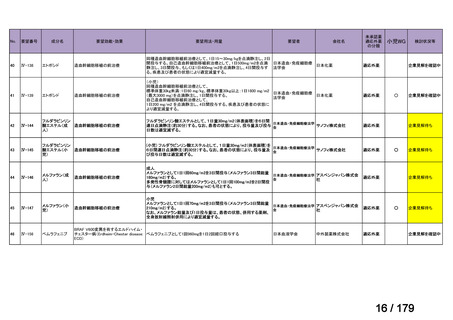
2) Huang Y et al. Impact of tumor necrosis factor α inhibitors on MRI inflammation in axial
spondyloarthritis assessed by Spondyloarthritis Research Consortium Canada score: A metaanalysis. PLoS One 2020; 15: e024478818)
Spondyloarthritis Research Consortium Canada(SPARCC)スコアを用いて、axSpA における
MRI 炎症に対する TNF 阻害薬の効果を検討したメタ・アナリシスに関する論文である。
11
40 / 179