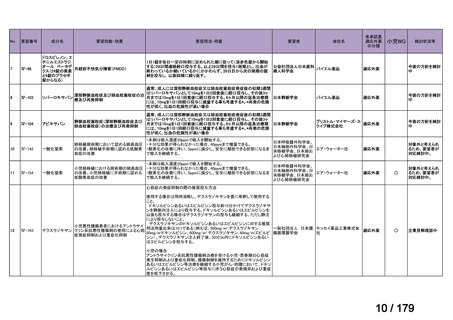
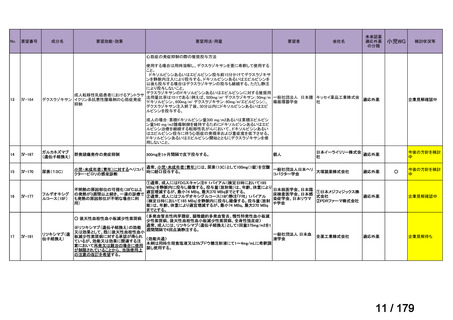
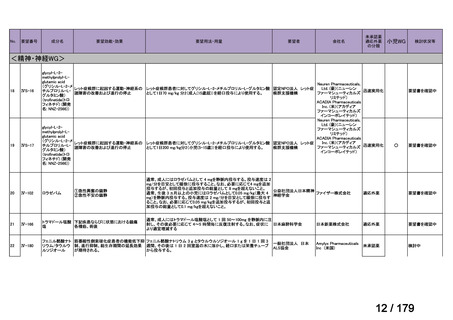
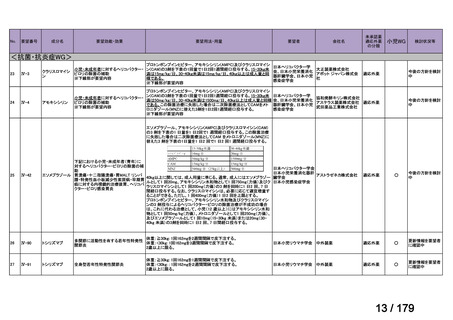
会議資料 (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00033.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第59回 7/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
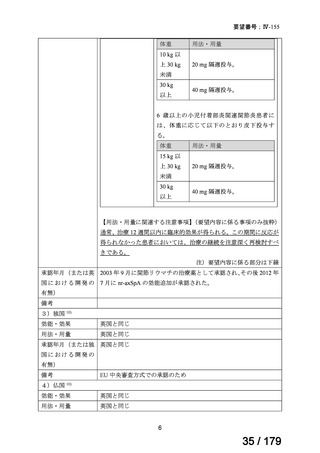
承認年月(または仏 英国と同じ
国における開発の
有無)
備考
EU 中央審査方式での承認のため
5)加国 11)
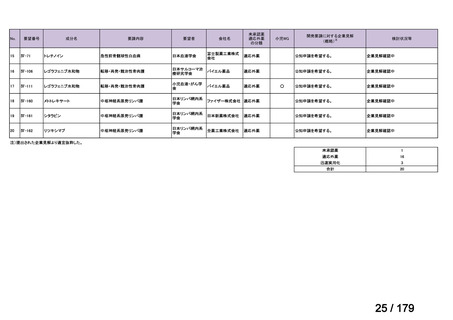
効能・効果
用法・用量
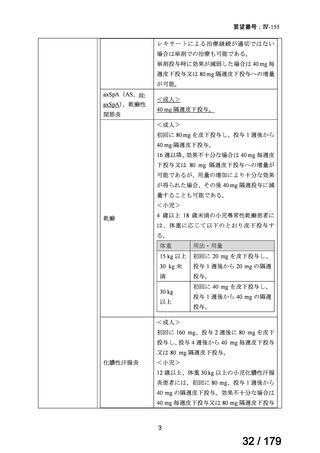
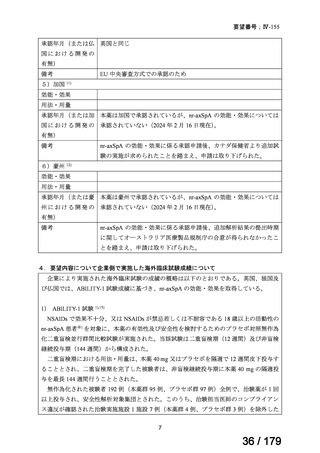
承認年月(または加 本薬は加国で承認されているが、nr-axSpA の効能・効果については
国 に お け る 開 発 の 承認されていない(2024 年 2 月 16 日現在)。
有無)
備考
nr-axSpA の効能・効果に係る承認申請後、カナダ保健省より追加試
験の実施が求められたことを踏まえ、申請は取り下げられた。
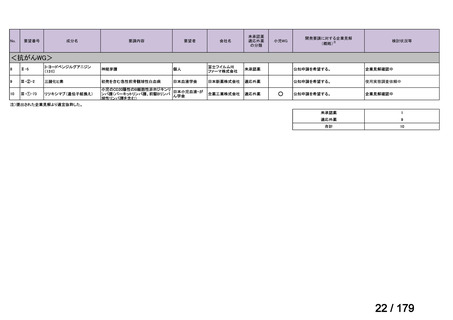
6)豪州 12)
効能・効果
用法・用量
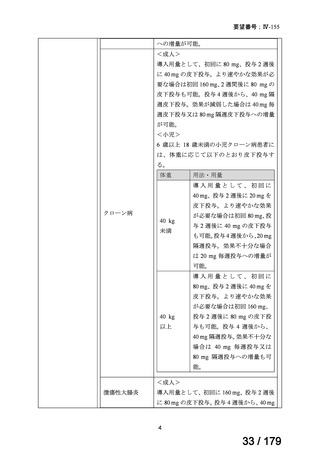
承認年月(または豪 本薬は豪州で承認されているが、nr-axSpA の効能・効果については
州 に お け る 開 発 の 承認されていない(2024 年 2 月 16 日現在)。
有無)
備考
nr-axSpA の効能・効果に係る承認申請後、追加解析結果の提出時期
に関してオーストラリア医療製品規制庁の合意が得られなかったこ
とを踏まえ、申請は取り下げられた。
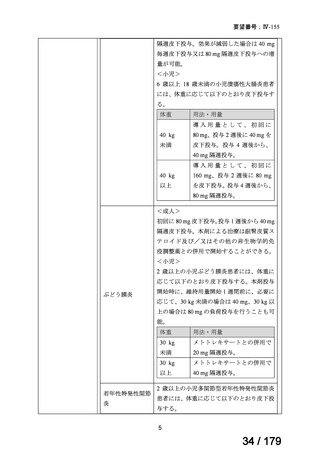
4.要望内容について企業側で実施した海外臨床試験成績について
企業により実施された海外臨床試験の成績の概略は以下のとおりである。英国、独国及
び仏国では、ABILITY-1 試験成績に基づき、nr-axSpA の効能・効果を取得している。
1) ABILITY-1 試験 1),13)
NSAIDs で効果不十分、又は NSAIDs が禁忌若しくは不耐容である 18 歳以上の活動性の
nr-axSpA 患者※1 を対象に、本薬の有効性及び安全性を検討するためのプラセボ対照無作為
化二重盲検並行群間比較試験が実施された。当該試験は二重盲検期(12 週間)及び非盲検
継続投与期(144 週間)から構成された。
二重盲検期における用法・用量は、本薬 40 mg 又はプラセボを隔週で 12 週間皮下投与す
ることとされ、二重盲検期を完了した被験者は、非盲検継続投与期に本薬 40 mg の隔週投
与を最長 144 週間行うこととされた。
無作為化された被験者 192 例(本薬群 95 例、プラセボ群 97 例)全例で、治験薬が 1 回
以上投与され、安全性解析対象集団とされた。このうち、治験担当医師のコンプライアン
ス違反が確認された治験実施施設 1 施設 7 例(本薬群 4 例、プラセボ群 3 例)を除外した
7
36 / 179