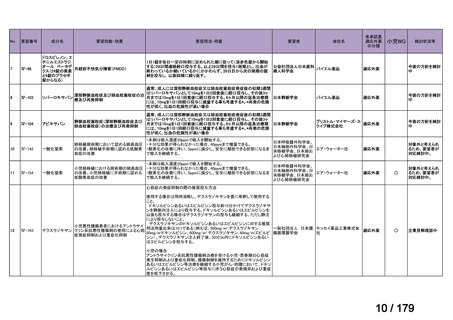
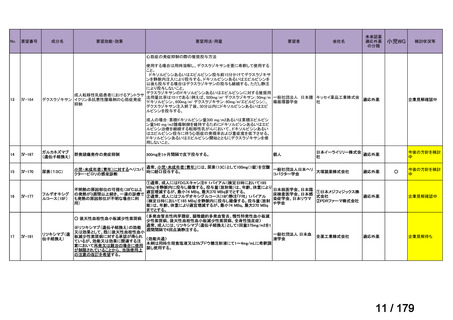
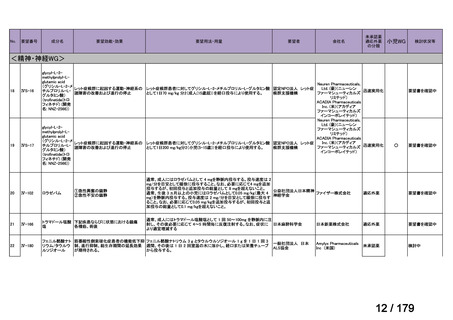
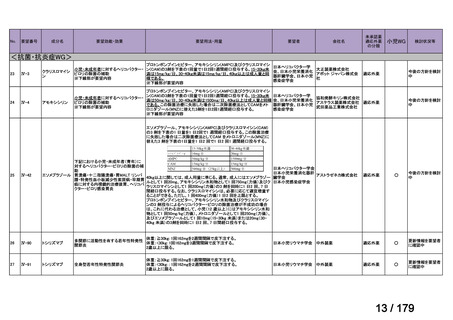
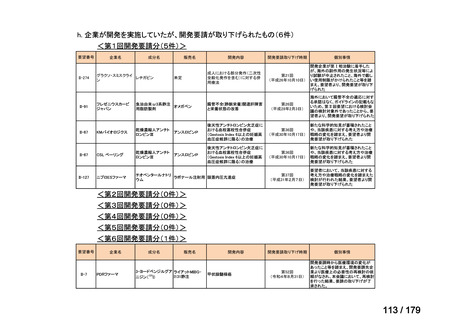
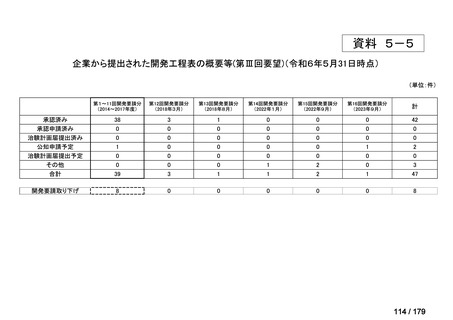
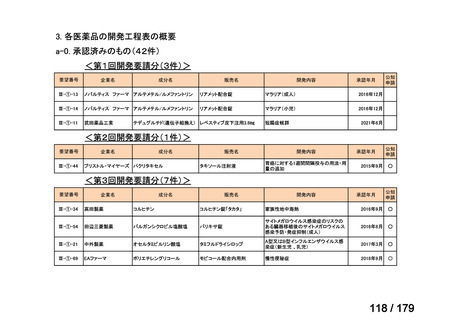
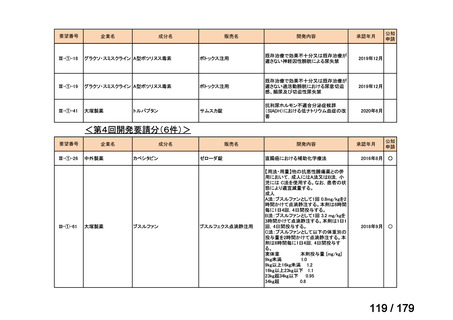
会議資料 (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00033.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第59回 7/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
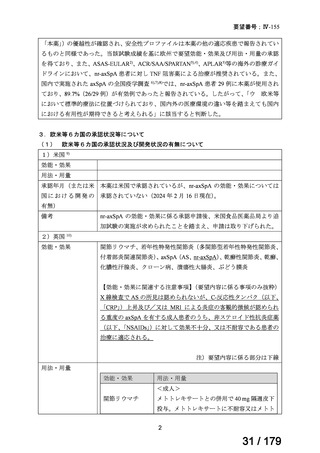
症候群/全身性エリテマトーデスが各 1 例(0.2 件/100 人・年)に認められた。
悪性腫瘍、血管炎、脱髄疾患及び B 型肝炎の再活性化は認められなかった。
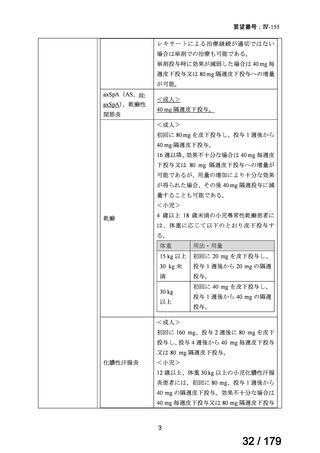
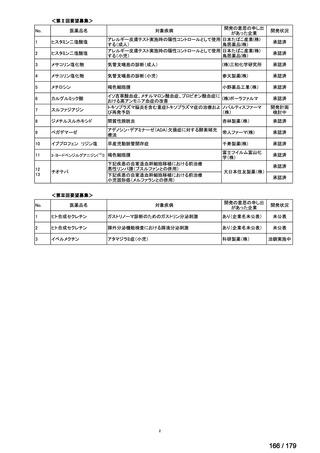
※1 主な組入れ基準:①axSpA の ASAS(Assessment of SpondyloArthritis international Society)分類基準を満た
す、②AS に対する 1984 年改訂ニューヨーク基準を満たさない、③総背部痛スコア(VAS(visual analogue
scale)
:0~10 cm)4 以上かつ BASDAI(Bath ankylosing spondylitis disease activity index)スコア 4 以上の活
動性である、④乾癬及び乾癬性関節炎の診断及び既往歴、並びに異なる病因の炎症性関節炎の既往歴がな
い、⑤生物製剤を過去に使用していない
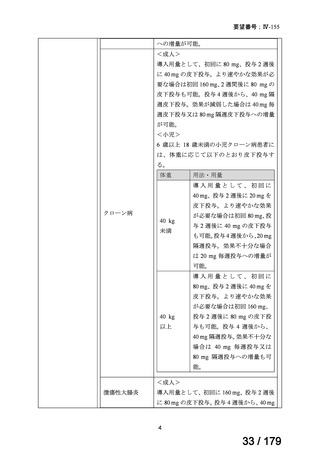
※2 以下の①~④のうち 3 項目以上で、ベースラインから 40%以上の改善及び 2 単位以上(0~10 スケール)
の改善を認め、かつ、残りの項目で悪化が認められなかった被験者の割合
①疾患活動性の患者による全般的評価(VAS:0~10 cm)
②疼痛(総背部痛、VAS:0~10 cm)
③機能(BASFI(Bath ankylosing spondylitis functional index)
、VAS:0~10 cm)
④炎症評価/朝のこわばり(BASDAI(VAS:10 cm)の Q5(朝のこわばりの程度)及び Q6(朝のこわば
りの継続時間)の平均値)
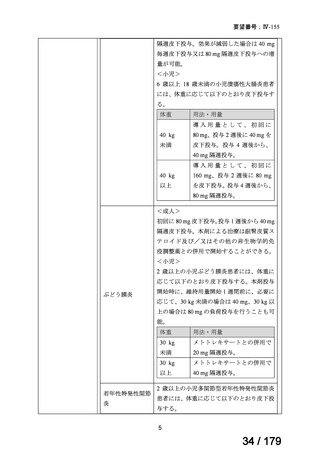
※3 ベースラインの MRI 画像に基づき仙腸関節若しくは脊椎の SPARCC(Spondyloarthritis Research Consortium
of Canada)スコアが 2 以上、又は CRP 上昇が認められた場合を炎症の客観的な兆候があると定義
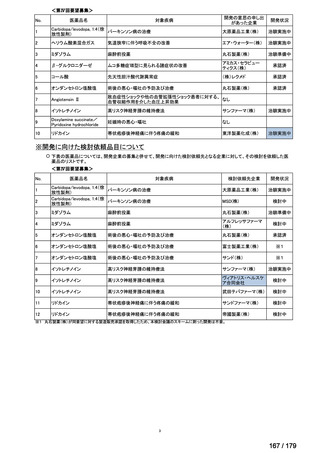
2) ABILITY-3 試験 14)
少なくとも 2 種類の NSAIDs で効果不十分、又は NSAIDs が禁忌若しくは不耐容である
18 歳以上の活動性の nr-axSpA 患者※4 を対象に、本薬による持続的な臨床的寛解の達成後、
本薬の投与中止の可否を検討するプラセボ対象無作為化二重盲検並行群間比較試験が実施
された。当該試験は、非盲検導入期(28 週間)及び二重盲検期(40 週間)で構成され、非
盲検導入期では、全例に本薬 40 mg の隔週皮下投与が行われ、持続的寛解(本薬投与 16、
20、24 及び 28 週時に ASDAS(Ankylosing spondylitis disease activity score)1.3 未満の達成
と定義)を認めた被験者を 28 週時に本薬 40 mg 隔週皮下投与を継続する群又は本薬投与を
中止しプラセボを投与する群に無作為に割り付けた。
非盲検導入期に 673 例が登録され、28 週時に持続的寛解を達成した 305 例が無作為化さ
れた(本薬群 152 例、プラセボ群 153 例)
。
有効性について、主要評価項目である二重盲検期に再燃(2 回の連続した来院で ASDAS
2.1 以上と定義)しなかった患者の割合は、本薬群 70%(107/152 例)、プラセボ群 47%(72/153
例)であり、プラセボ群と比較して本薬群で有意に高かった(p<0.0001、NRI、
検定)。
二重盲検期における安全性について、有害事象は本薬群 65%(99/152 例)
、プラセボ群
69%(105/153 例)に認められ、本薬群及びプラセボ群で発現割合の高かった有害事象とし
て、上咽頭炎が本薬群 16%(25/152 例)
、プラセボ群 13%(20/153 例)
、上気道感染が本薬
群 13%(20/152 例)、プラセボ群 8%(12/153 例)
、axSpA の悪化が本薬群 7%(10/152 例)
、
プラセボ群 14%(21/153 例)に認められた。死亡は両群ともに認められなかった。
重篤な有害事象は本薬群 1%(1/152 例)
、プラセボ群 7%(10/153 例)、投与中止に至った
有害事象は本薬群 0%(0/152 例)、プラセボ群 3%(4/153 例)に認められた。
感染症は本薬群 53%(80/152 例)、プラセボ群 46%(70/153 例)に認められ、そのうち重
篤な感染症は本薬群 0%(0/152 例)、プラセボ群 1%(2/153 例)に認められた。悪性腫瘍は
本薬群 0%(0/152 例)、プラセボ群 1%(2/153 例)に認められた。
9
38 / 179