会議資料 (48 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00033.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第59回 7/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
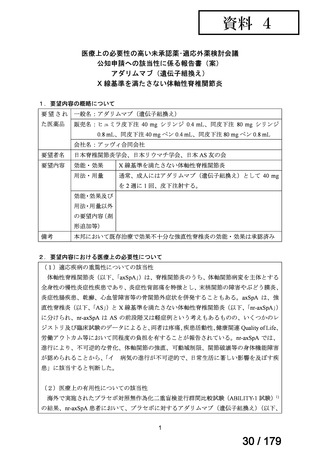
【設定の妥当性について】
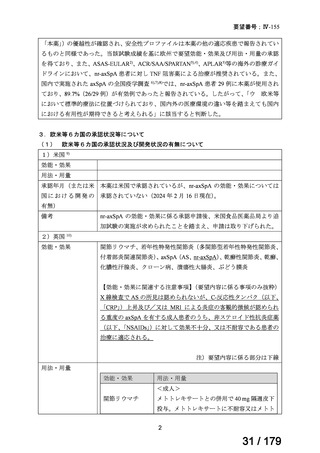
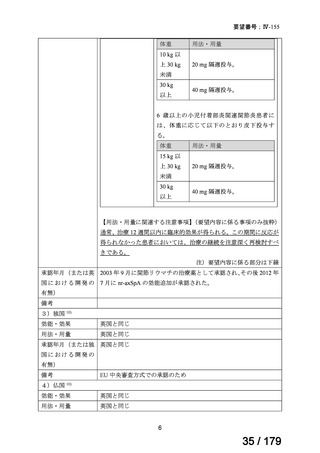
欧州では、nr-axSpA に対して本薬 40 mg の隔週皮下投与が承認されている。また、国内
における axSpA 患者を対象とした全国疫学調査(第 1 回)では本薬の使用用法・用量の情
報は収集されていないものの、nr-axSpA は AS と同一の疾患スペクトラムと考えられてお
り、国内の診療ガイドラインでは nr-axSpA に対して AS に準じた治療が行われている旨が
記載され、国内における AS の基本用法・用量は本薬 40 mg 隔週投与である。
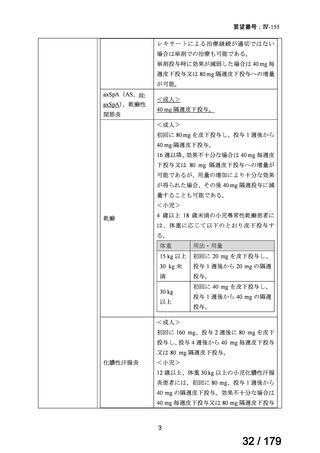
検討会議は、以上を踏まえ、nr-axSpA に対する用法・用量は、要望用法・用量のとおり、
「通常、成人にはアダリムマブ(遺伝子組換え)として 40 mg を 2 週に 1 回、皮下注射す
る。」と設定することが適切と考える。
また、海外の添付文書では、海外臨床試験成績を根拠として、nr-axSpA 患者に対する本
薬の臨床的効果は通常 12 週間以内に得られる旨、及び当該期間に反応が得られなかった患
者においては、治療の継続を注意深く再検討すべきである旨が注意喚起されている。本邦
の添付文書では AS に対し本薬の効果判定時期に係る内容が注意喚起されていることも踏
まえ、nr-axSpA に対する用法・用量に関連する注意として、「本剤による治療反応は、通
常投与開始から 12 週以内に得られる。12 週以内に治療反応が得られない場合は、現在の
治療計画の継続を慎重に再考する」旨を注意喚起することが適切と考える。
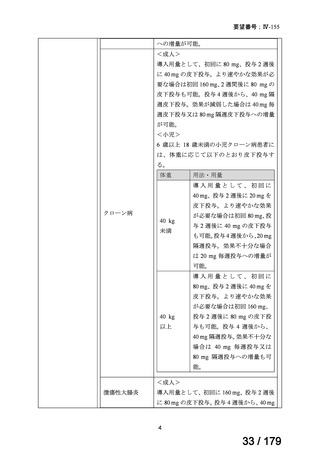
なお、要望された医薬品は、ヒュミラ皮下注 40 mg シリンジ 0.4 mL、同皮下注 80 mg シ
リンジ 0.8 mL、同皮下注 40 mg ペン 0.4 mL、同皮下注 80 mg ペン 0.8 mL であるものの、1
回で全量を使用する製剤であり、再使用しない旨が注意喚起されていることを踏まえると、
ヒュミラ皮下注 40 mg シリンジ 0.4 mL 及び同皮下注 40 mg ペン 0.4 mL に対してのみ、nraxSpA に係る効能・効果及び用法・用量を設定することが適切と考える。
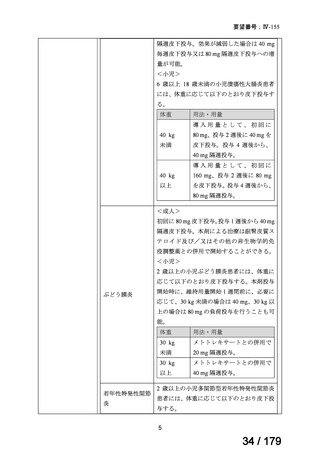
9.要望内容に係る更なる使用実態調査等の必要性について
(1)要望内容について現時点で国内外のエビデンスまたは臨床使用実態が不足している点
の有無について
「4.要望内容について企業側で実施した海外臨床試験成績について」及び「5.要望
内容に係る国内外の公表文献・成書等について」の項に記載したとおり、今回の要望内容
については、国内外において有効性及び安全性に関する一定のエビデンスが得られている。
したがって、現時点で、追加すべき試験又は調査はないと考える。
(2)上記(1)で臨床使用実態が不足している場合は、必要とされる使用実態調査等の内
容について
なし
(3)その他、製造販売後における留意点について
なし
19
48 / 179