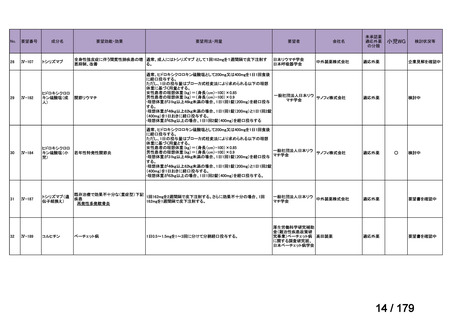
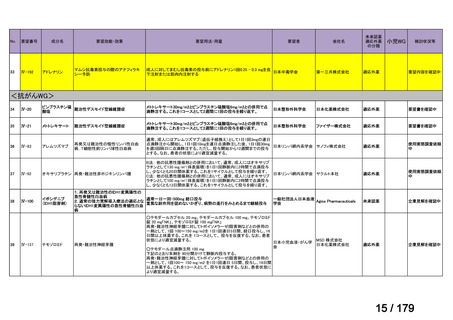
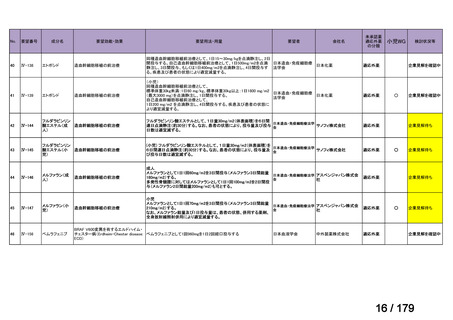
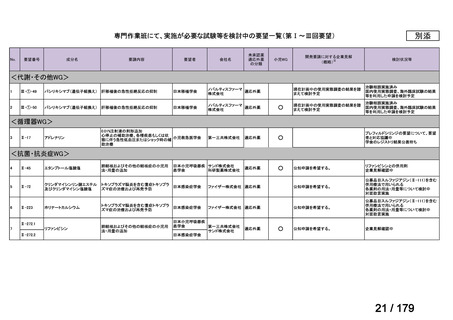
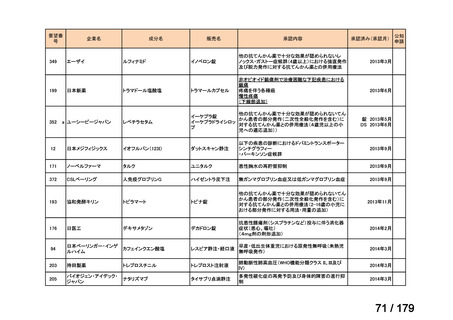
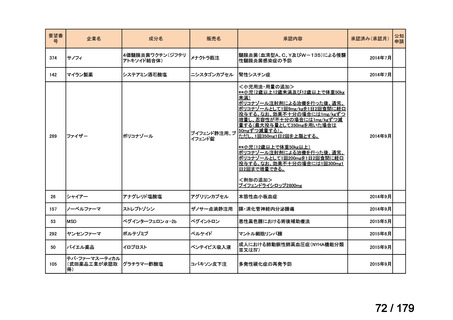
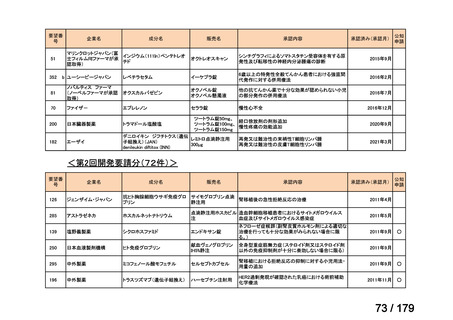
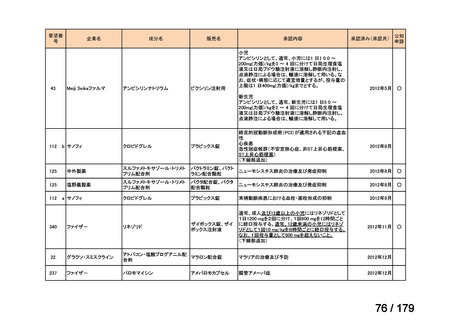
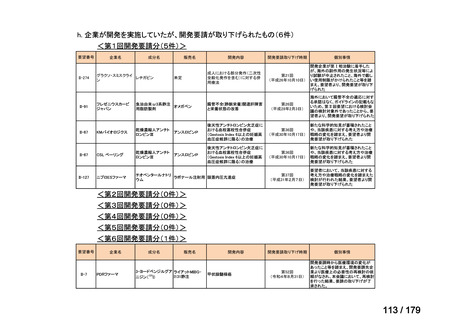
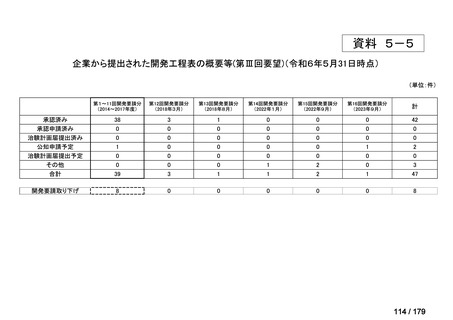
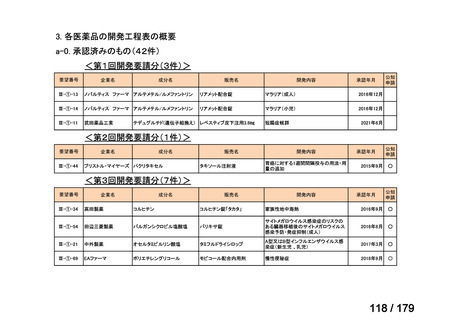
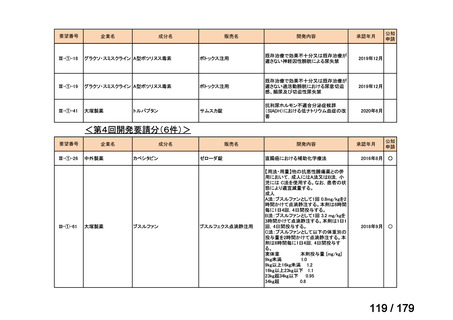
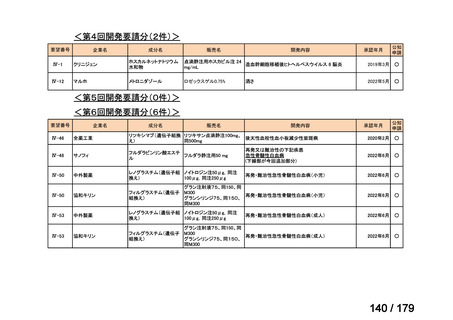
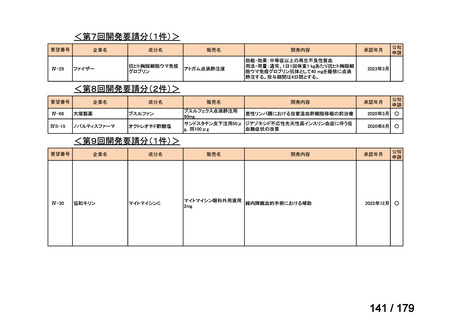
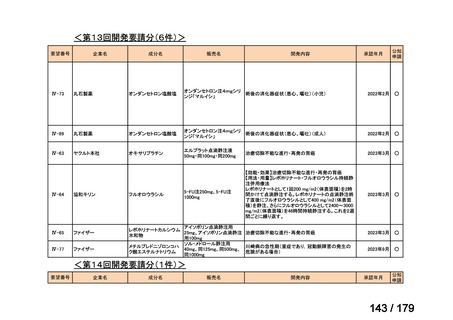
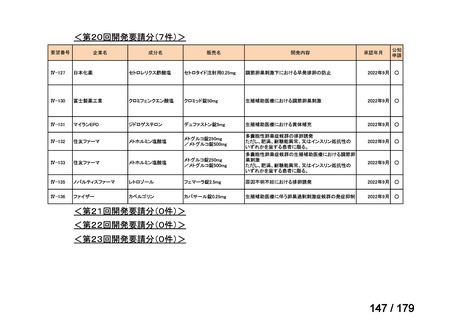
会議資料 (169 ページ)
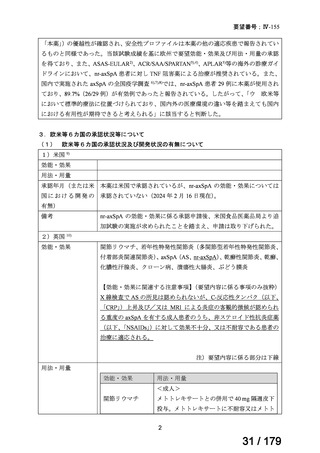
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00033.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第59回 7/5)《厚生労働省》 |
ページ画像
プレーンテキスト
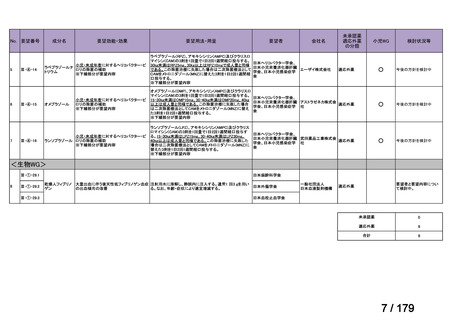
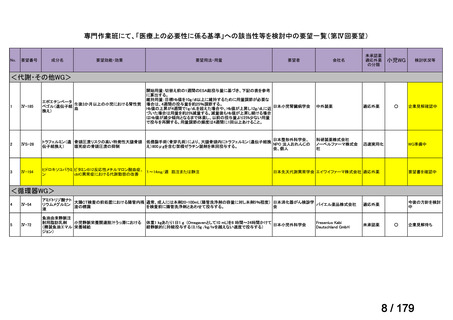
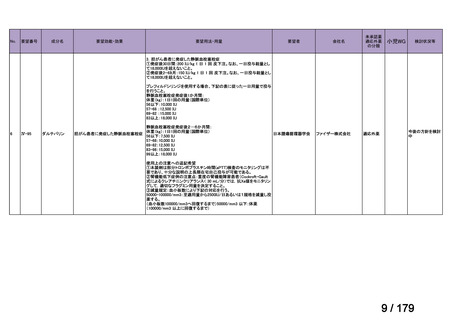
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
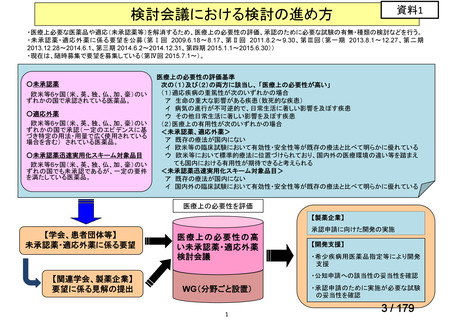
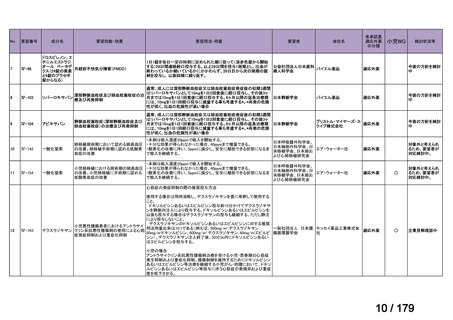
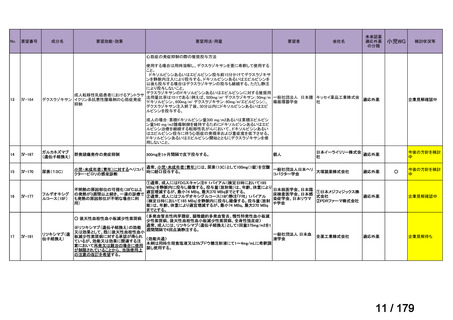
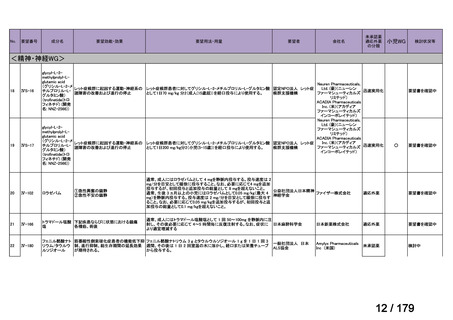
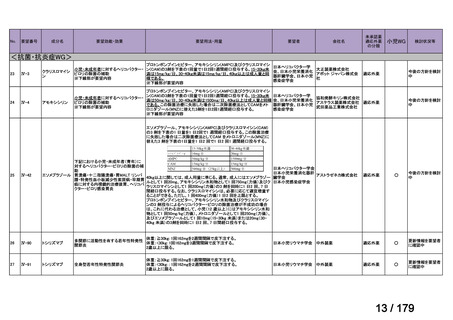
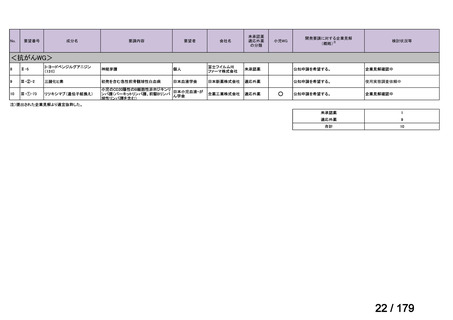
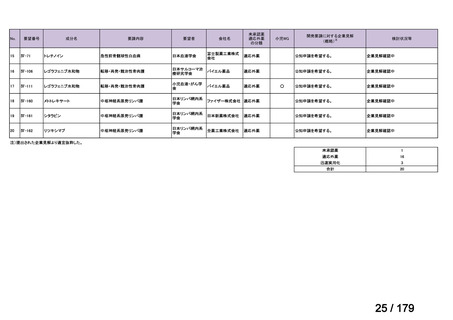
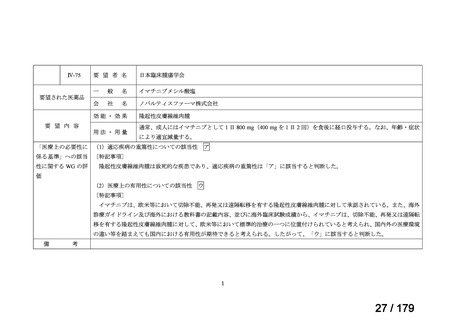
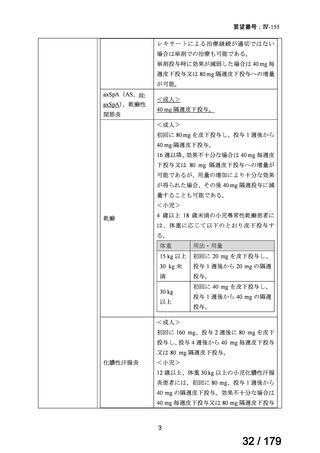
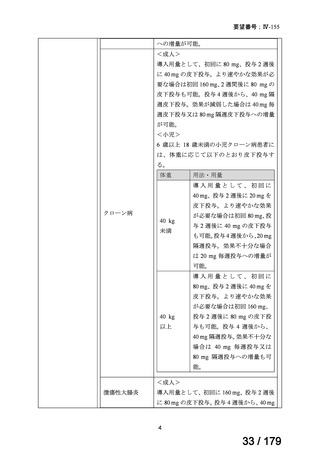
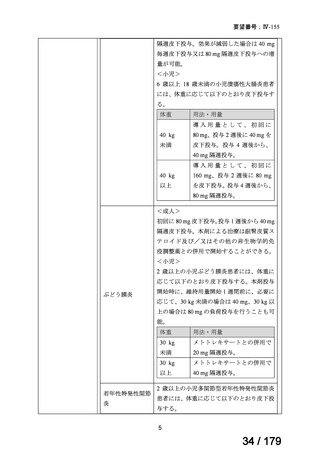
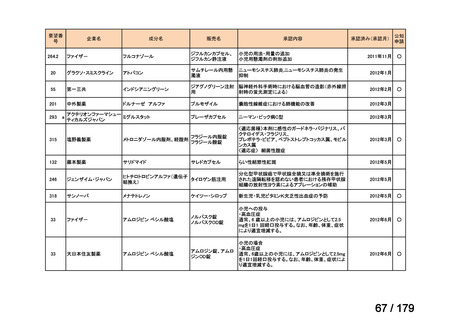
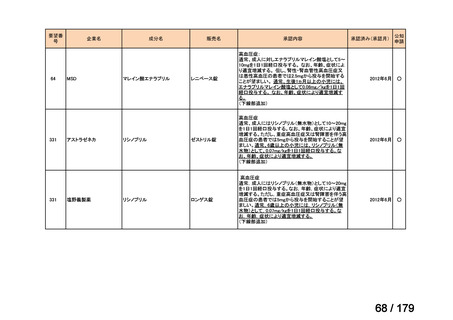
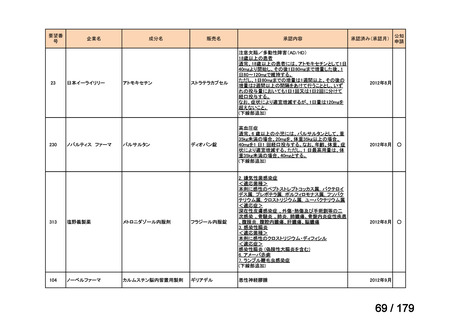
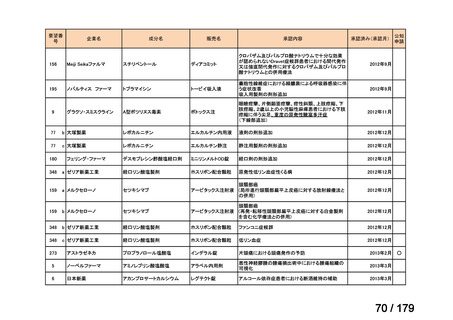
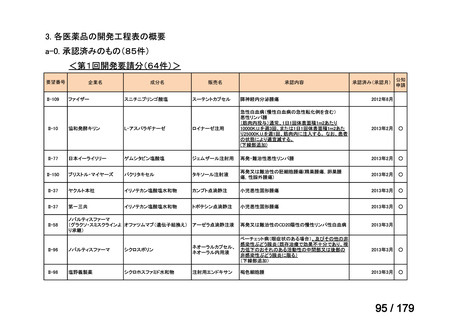
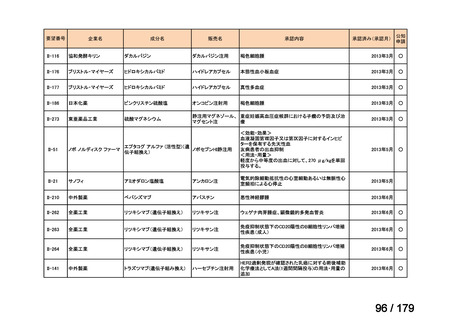
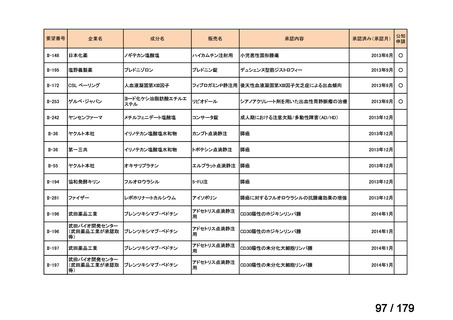
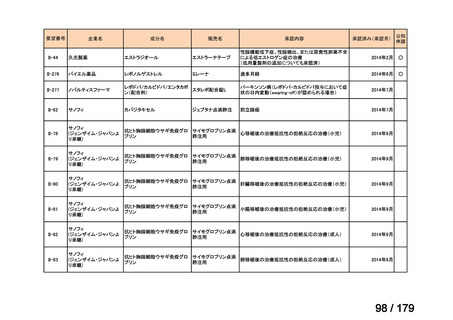
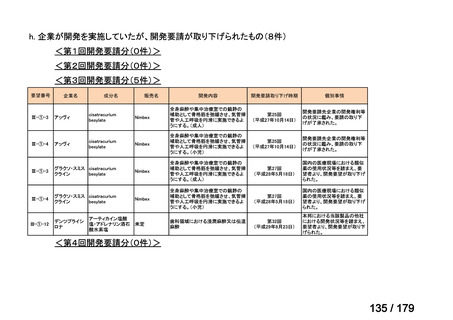
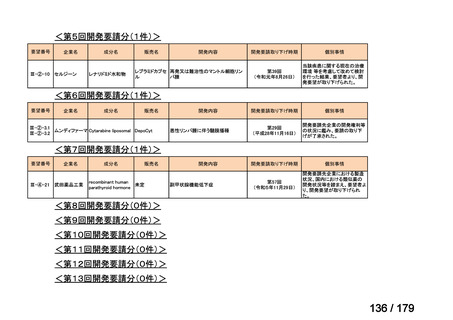
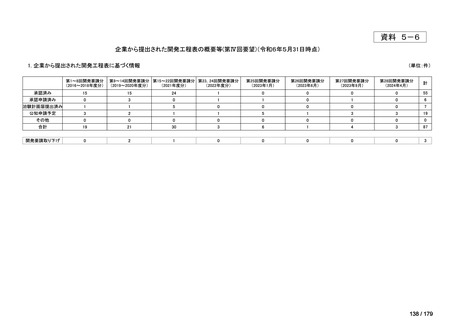
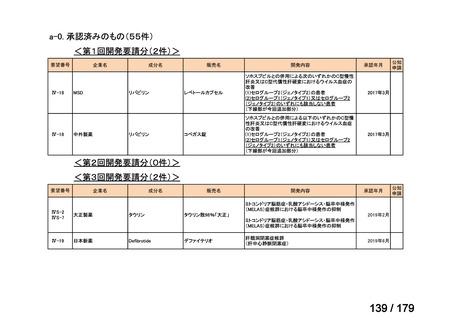
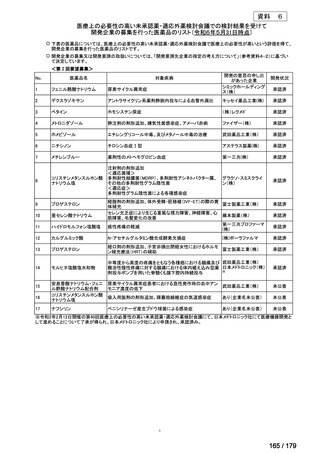
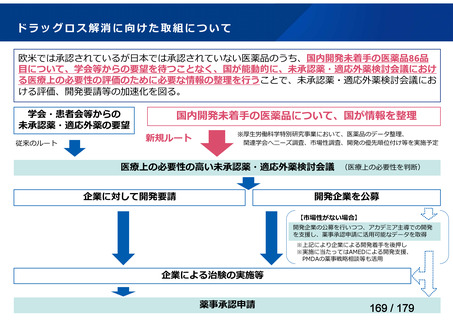
欧米では承認されているが日本では承認されていない医薬品のうち、国内開発未着手の医薬品86品
目について、学会等からの要望を待つことなく、国が能動的に、未承認薬・適応外薬検討会議におけ
る医療上の必要性の評価のために必要な情報の整理を行うことで、未承認薬・適応外薬検討会議にお
ける評価、開発要請等の加速化を図る。
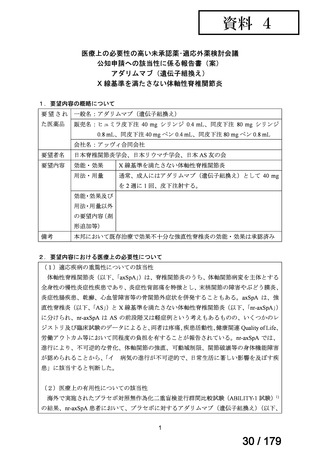
学会・患者会等からの
未承認薬・適応外薬の要望
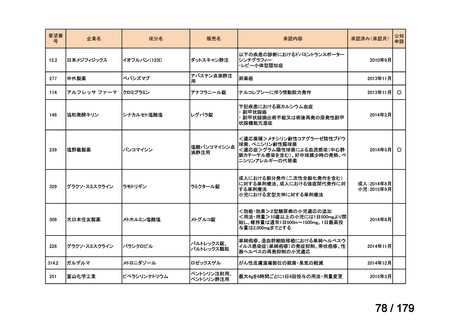
従来のルート
国内開発未着手の医薬品について、国が情報を整理
新規ルート
※厚生労働科学特別研究事業において、医薬品のデータ整理、
関連学会へニーズ調査、市場性調査、開発の優先順位付け等を実施予定
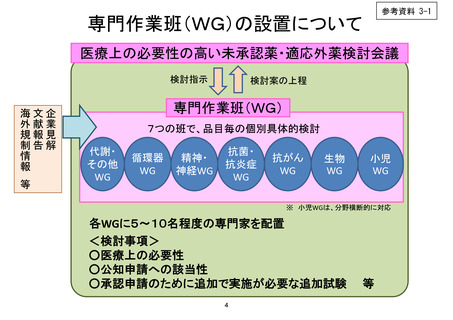
医療上の必要性の高い未承認薬・適応外薬検討会議
企業に対して開発要請
(医療上の必要性を判断)
開発企業を公募
【市場性がない場合】
開発企業の公募を行いつつ、アカデミア主導での開発
を支援し、薬事承認申請に活用可能なデータを取得
※上記により企業による開発着手を後押し
※実施に当たってはAMEDによる開発支援、
PMDAの薬事戦略相談等も活用
企業による治験の実施等
薬事承認申請
169 / 179